微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下
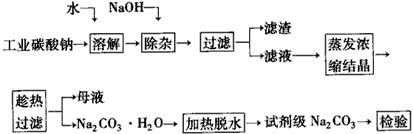
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示

|
回答下列问题
(1)滤渣的主要成分为_____________
(2)“趁热过滤”的原因是___________。
(3)若在实验室进行“趁热过滤”,可采取的措施是___________(写出一种)
(4)若“母液”循环使用,可能出现的问题及其原因是______________________。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
参考答案:(1)Mg(OH)2、Fe(OH)3、CaCO3
(2)使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体或Na2CO3·7H2O晶体,使后续的加热脱水耗时长
(3)用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤)
(4)产品纯度降低,因为循环使用时母液中Cl-与SO42-浓度增大,导致产品含有NaCl或Na2SO4杂质。
(5)Na2CO3·H2O(s)== Na2CO3(s)+ H2O(g) △H= +58.73kJ/mol
本题解析:
本题难度:一般
2、填空题 下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
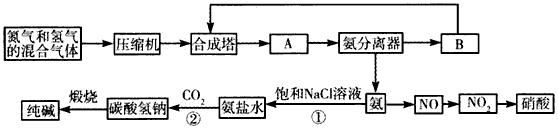
(1)设备A的名称是________,设备B的名称是___________。
(2)有关合成氨工业的说法中,正确的是__________(填序号)。
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?______(填“能”或“否”),为什么?________________________。若产品纯碱中含有碳酸氢钠,用加热分解的方法测定纯碱中碳酸氢钠的质量分 数,则其质量分数可表示为___________________________ (注明表达式中所用符号的含义)。
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气的主要成分而除去。写出甲烷与NO2反应的化学方程式:____________________。若基于下列反应的方法治理:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O;标准状况下NO、NO2的混合物恰好与50 mL 2.0 mol/L的NaOH溶液完全反应,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO的体积分数为_________。
参考答案:(1)冷凝器;循环压缩机
(2)B
(3)否;因为CO2在水中的溶解度较小,顺序颠倒后得不到较高浓度的HCO3-,所以没有NaHCO3生成;
w(NaHCO3)=84(m1-m2)/3m1(其中m1是混合物的质量,m2是加热后剩余固体的质量)
(4)CH4+2NO2 N2+CO2+2H2O;0.3
N2+CO2+2H2O;0.3
本题解析:
本题难度:一般
3、简答题 工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;?
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号).
a.碳酸氢钠难溶于水?b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
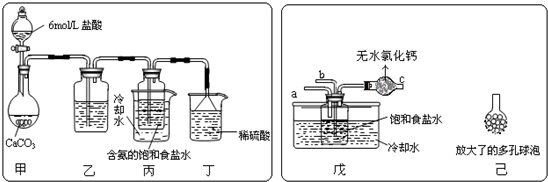
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______,其作用是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3?晶体的操作是______(填分离操作的名称),该操作所需要的玻璃仪器有______.
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入______气体,说明原因______.
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______.
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为______.
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:______.
参考答案:(1)a、碳酸氢钠易溶于水;故a不符合;
b、碳酸氢钠的受热分解与该现象无关,故b不符合;
c、碳酸氢钠的稳定性不如碳酸钠;由于对于氯化铵来说碳酸氢钠的溶解度更小一些,所以应首先析出;
d、碳酸氢钠的稳定性小于碳酸钠,故d不符合;
故答案为:c.
(2)①(I)利用盐酸制取二氧化碳时二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应,所以通过饱和碳酸氢钠的溶液是为了除掉气体中的氯化氢气体,
故答案为:饱和碳酸氢钠的溶液;除去CO2中的HCl气体;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应完的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作;该操作所需要的玻璃仪器为:玻璃棒、漏斗、烧杯,故答案为:过滤;玻璃棒、漏斗、烧杯;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,而氨气极易溶于水,所以a端通入,从而保证了从b通入二氧化碳时保证了二氧化碳的充分反应;氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,
故答案为:氨气;氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,
故答案为:增大气体与溶液接触面积,提高CO2的吸收率;
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数可以依据化学方程式进行计算得到;
发生的反应为:2NaHCO3=Na2CO3+CO2↑+H2O,
NaHCO3+Ca(OH)2=CaCO3↓+H2O+Na OH;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;反应生成的碳酸钙物质的量=12g100g/mol=0.12mol;
设加热后的固体12,28g中含碳酸钠物质的量x,碳酸氢钠物质的量为y,依据题意得到:
x+y=0.12
106x+84y=12.28
得到x=0.1mol;y=0.02mol;
则所得固体中碳酸钠的质量分数=0.1mol×106g/mol12.28g×100%=86.3%,
故答案为:86.3%;
(4)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2;往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠;
故答案为:用碳酸氢铵与适量饱和食盐水反应(或往烧碱溶液中通入过量CO2;往饱和Na2CO3溶液中通入过量CO2等).
本题解析:
本题难度:一般
4、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:______________;
(2)写出“联合制碱法”有关反应的化学方程式______________。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于______________,“氨碱法”中CO2来源于______________。
参考答案:(1)2NH4Cl + Ca(OH)2 =CaCl2 + 2NH3↑+ 2H2O?
(2)NH3 + H2O + CO2 + NaCl(饱和) = NaHCO3↓+ NH4Cl、2NaHCO3 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O
(3)合成氨厂;煅烧石灰石
本题解析:
本题难度:一般
5、填空题 在动物饲料中添加三聚氰胺,将提高饲料中的氮含量,让人误以为该饲料的蛋白质比较丰富,其营养价值实际上却没有增加关于三聚氰胺的合成,目前较多采用尿素法,因为此法成本低。尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应,先分解生成氰酸(HCNO),并进一步缩合生成三聚氰胺生成的三聚氰胺气体经冷却捕集后得粗品,然后经溶解,除去杂质,重结晶得成品。下图是简单流程图,已知a、b为气体,且a极易溶于水,回答下列问题:
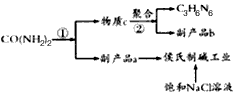
(1)反应①的化学方程式为_____________________;
(2)物质b为_____________________,反应②的化学方程式为____________________________;
(3)相同状态下,产生的气体a和b的体积之比为________________________________;
(4)我国著名化学家候德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中外。本实验具体操作过程中,应先通________________气体,再通_____________________气体;某同学进行了侯氏制碱的模拟实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0g,则其产率为____________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是___________________________________。
参考答案:(1)CO(NH2)2 HNCO+NH3↑
HNCO+NH3↑
(2)CO2;6HNCO→C3H6N6+3CO2↑
(3)2:1
(4)NH3;CO2;49.1%;NaHCO3在水中有较大的溶解度,未能全部沉淀出来
本题解析:
本题难度:一般