| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子方程式的书写及正误判断》试题预测(2017年最新版)(十)
参考答案: 本题解析: 本题难度:一般 2、简答题 (16分)某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程: 参考答案:(1)过滤(2分) 本题解析:煤渣主要含有Al2O3、SiO2,煤渣和稀硫酸混合,发生反应Al2O3+3H2SO4 本题难度:困难 3、选择题 下列各组离子在强酸性溶液中能大量共存的是 |
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (14分)Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑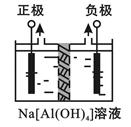
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是_____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO
B.Al(OH)3
C.NaOH
D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是__________________________。
参考答案:(14分)
(1)阳极 (2)2 (3)10-9~10-7
(4)加KSCN溶液,溶液变血红色
(5)2Fe2+ + 2H2O2 + 2H+ = 2Fe3+ + 2H2O
(6)B pH过小Fe3+沉淀不完全,pH过大Al3+可能因沉淀而损失
本题解析:(1)根据电解的总反应可知,阳极:4OH--4e-=2H2O+O2↑,电解质溶液是Na[Al(OH)4]溶液,OH-来源与水的电离,随着OH-的消耗,水的电离平衡向电离的方向移动,H+浓度增加,随后发生H++[Al(OH)4]-=Al(OH)3↓+H2O,所以Al(OH)3在阳极区沉积。
(2)根据阳极:4OH--4e-=2H2O+O2↑,H2O H++OH-, H++[Al(OH)4]-=Al(OH)3↓+H2O
H++OH-, H++[Al(OH)4]-=Al(OH)3↓+H2O
4 4 4 4 4 4
2 2 2 2 2 2
电解中转移2mol e—时,将制得2mol的Al(OH)3.
(3)将分散质微粒直径介于1-100nm之间的分散系称为胶体,所以纳米氧化铝的直径约为10-9~10-7 m。
(4)向溶液中加入KSCN溶液,若溶液变血红色,则证明该溶液中有Fe3+.
(5)室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,而Fe3+完全沉淀的pH=3.2,我们一般将Fe2+氧化成Fe3+,再通过调节PH值除去杂质铁元素,所以往溶液中加入H2O2的作用是2Fe2+ + 2H2O2 + 2H+ = 2Fe3+ + 2H2O。
(6)要除去铝离子中的铁离子,根据Fe3++3H2O =Fe(OH)3 +3H+,加入与H+反应的物质,且不引入新的杂质,那么必须加入铝及铝的化合物,所以选B,若调节后溶液的pH偏离3.5,可能带来的后果是pH过小Fe3+沉淀不完全,pH过大Al3+可能因沉淀而损失。
考点:考查电解的工作原理,胶体的定义,Fe3+的检验与物质的除杂等知识。
本题难度:困难
5、选择题 下列离子方程式书写正确的是
A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.明矾溶液中滴加Ba(OH)2溶液至SO42
参考答案:
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡》.. | |