微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列物质的水溶液,其pH小于7的是
A.Na2CO3
B.NH4NO3
C.Na2SO4
D.KNO3
参考答案:B
本题解析:正确答案B
A.?CO32―+H2O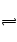 HCO3―+OH―水解呈碱性
HCO3―+OH―水解呈碱性
B.?NH4++H2O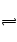 NH3·H2O+H+水解呈酸性。
NH3·H2O+H+水解呈酸性。
C、Na2SO4? D、KNO3均为强酸强碱盐,不水解,呈中性
本题难度:简单
2、选择题 下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
A.Na2CO3
B.AlCl3
C.NaCl
D.NH4Cl
参考答案:A
本题解析:A、正确;B、加热时水解产生的HCl挥发,平衡正向移动得到氢氧化铝,错误;C、不水解,错误;D、受热易分解,错误。
本题难度:一般
3、填空题 (12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量浓度
(mol·L-1)
| NaOH物质的量浓度
(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| C1
| 0.2
| pH=7
|
丙
| 0.1
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
|
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?。
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1??(填“是”或“否”)。混合溶液中c(A-)与 c(Na+)离子浓度的大小关系是?(填序号)。A.前者大? B.后者大? C.一样大? D.无法判断
c(Na+)离子浓度的大小关系是?(填序号)。A.前者大? B.后者大? C.一样大? D.无法判断
(3)从丙组结果分析,HA是?酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是?。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=?mol·L-1。
参考答案:
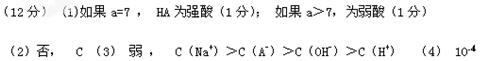
本题解析:略
本题难度:一般
4、选择题 0.1 mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
A.NH3·H2O
B.NH4Cl
C.HCl
D.HCOOH
参考答案:C
本题解析:盐酸是强酸,盐所以盐酸溶液中氢离子的浓度最大,酸性最强。答案选C。
本题难度:简单
5、填空题 A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)相同温度下,当A1、B1的物质的量浓度相等时,两种溶液中水电离出的氢离子的物质的量浓度之比为________。
(3)0.1mol?L-1NaNO2溶液中离子浓度由大到小的顺序为___________________________________。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
参考答案:(1)NaOH;NaNO2;HNO3;NH4NO3(2)1∶1(3)c(Na+)>c(NO2-) >c(OH-)>c(H+)
(4)硝酸电离出的氢离子抑制了水的电离,NH4+的存在促进了水的电离 (5)1×10-4∶1
本题解析:(1)根据给出的元素:H、N、O、Na,其中由三种元素组成的强电解质,中学化学常见物质有:强碱(NaOH)、强酸(HNO3);盐:NaNO3、NaNO2、NH4NO3、NH4NO2等。A显碱性,只可能是NaOH和NaNO2,B显酸性,可能是HNO3和NH4NO3。强酸、强碱都抑制水的电离,而易水解的盐则促进水的电离。相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,故A1为NaOH,A2为NaNO2;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,故B1为HNO3,B2为NH4NO3。
(2)强酸或强碱溶液中氢离子或OH-浓度在相等的条件下对水电离的抑制程度是相同,则两种溶液中水电离出的氢离子的物质的量浓度之比为1∶1。
(3)亚硝酸钠是强碱弱酸盐,水解溶液显碱性,则溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-) >c(OH-)>c(H+)。
(4)由于硝酸电离出的氢离子抑制了水的电离,而NH4+的水解促进了水的电离,所以B1溶液中水的电离程度小于B2溶液中水的电离程度。
(5)硝酸抑制水的电离,硝酸铵促进水的电离,所以如果两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为10-9:10-5=1×10-4∶1。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题解题的关键是明确外界条件对水的电离平衡的影响,然后结合题意灵活运用即可。
本题难度:一般