微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知硫在纯氧中燃烧火焰更明亮,在相同温度和压强下,将两份32g的硫分别在纯氧气中和空气中完全燃烧,若前者放出热量为
Q1,后者放出热量为Q2,则关于Q1和Q2的相对大小正确的判断是( )
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
D.无法判断
参考答案:在相同的温度和压强下S的反应热是一个定值.将32g硫分别于纯氧中和空气中完全燃烧,只是放热的速率不同而总量相同,所以Q1=Q2.
故选A.
本题解析:
本题难度:一般
2、填空题 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol?SO2(g)氧化为1mol?SO3的ΔH=—99kJ·mol-1.请回答下列问题:
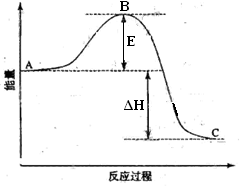
(1)图中A、C分别表示___________、___________;
(2)图中△H=?___________KJ·mol-1;
(3)已知单质硫的燃烧热为296?KJ·mol-1,写出表示硫燃烧的热化学方程式?___________;
(4)计算由S(s)生成3?molSO3(g)的△H?=?___________?。
参考答案:
(1)反应物能量?生成物能量(每空2分)
(2)-198(2分)
(3)?S(s)+O2(g)?=SO2(g)?△H1=-296?KJ·mol-1(3分)
(4)△H=-1185?KJ·mol-1(3分)
本题解析:
(1)根据图像可知A点表示反应物的总能量,C点表示生成物的总能量。
(2)1mol?SO2(g)氧化为1mol?SO3的ΔH=?—99kJ·mol-1.而在图像中表示的是生成2mol?SO3的能量变化示意图,所以反应热是—198kJ·mol-1.
(3)燃烧热是在一定条件下1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式为S(s)+O2(g)?=SO2(g)?△H1=-296KJ·mol-1。
(4)硫的燃烧热为296?kJ/mol,所以热化学方程式为①S(s)+O2(g)=SO2(g)△H=-296kJ·mol-1。将该反应和反应②2SO2(g)+O2(g) 2SO3(g)?△H=-198kJ·mol-1叠加,即①×2+②得到2S(s)+3O2(g)=2SO3(g),所以该反应的△H=-790kJ·mol-1。因此生成3mol三氧化硫气体放出的热量是
2SO3(g)?△H=-198kJ·mol-1叠加,即①×2+②得到2S(s)+3O2(g)=2SO3(g),所以该反应的△H=-790kJ·mol-1。因此生成3mol三氧化硫气体放出的热量是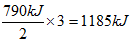 。
。
本题难度:一般
3、选择题 下列各组反应中的△H大小比较正确的是( )
| ? | 热化学方程式 | △H大小比较
|
A
S(g)+O2(g)=SO2(g)△H1 | △H1<△H2
S(s)+O2(g)=SO2(g)△H2
|
B
2H2(g)+O2(g)=2H2O(1)△H1 | △H1>△H2
2H2(g)+O2(g)=2H2O(g)△H2
|
C
CH3COOH(aq)+NaOH(aq)=CH3COOHNa(aq)+H2O(1)△H1 | △H1<△H2
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)△H2
|
D
2Na(s)+O2(g)=Na2O2△H1 | △H1>△H2
2Na(s)+O2(g)=Na2O2△H2
|
A.A
B.B
C.C
D.D
参考答案:A、依据盖斯定律固体硫变化为气态硫需要吸收热量,所以△H1<△H2 故A正确;
B、依据盖斯定律氢气和氧气反应生成液态水放热多,所以△H1<△H2,故B错误;
C、依据盖斯定律,CH3COOH(aq)+NaOH(aq)=CH3COOHNa(aq)+H2O(1)反应中醋酸是弱电解质,电离过程是吸热过程,反应△H1>△H2 ,故C错误
D、依据盖斯定律,反应是同一反应△H1=△H2,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 下列反应均为放热反应,其中热化学方程式中△H最小的是
[? ]
A. 2A ( l ) + B ( l ) = 2C (g ) △H1
B. 2A ( g ) + B ( g ) = 2C (g ) △H2
C. 2A ( g ) + B ( g ) = 2C ( l ) △H3
D. 2A ( l ) + B ( l ) = 2C ( l ) △H4
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.焓变是指在恒压、恒温下,体系不做体积功,只做其他功的变化过程的热效应
B.书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热
C.化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的
D.吸热反应的△H<0,放热反应的△H>0
参考答案:C
本题解析:
本题难度:简单