微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5 mol/L,c(NO3—)=1.4×10—5 mol/L,c(Ca2+)=1.5×10—5 mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
实验编号
| HA物质的量浓度(mol/L)
| NaOH物质的量浓度(mol/L)
| 混合溶液的pH
|
①
| 0.1
| 0.1
| pH=9
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH<7
|
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
参考答案:Ⅰ、pH=4
Ⅱ、HA > HC > HB > HD
Ⅲ、(1)弱酸;(2)10-5
(3)大于,c(A-)=c(Na+)
(4)大于,c(A-)>c(Na+)>c(H+)>c(OH-)
本题解析:Ⅰ、根据溶液中电荷守恒可知c(H+)=2×2.5×10-4+1.6×10-5+1.4×10-5-4×10-4-2×1.5×10-5=1×10-4,故溶液pH=4;Ⅱ、相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,故酸性HD<HB,NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色,则HA为强酸,HC为弱酸,同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,酸性HC>HB,故四种酸的酸性由强到弱的顺序为:HA > HC > HB > HD;Ⅲ、(1)由实验①可知NaA溶液pH=9,故HA为弱酸;(2)①组实验所得混合溶液中由水电离出的c(OH-)= 10-5mol·L-1;(3)②组溶液呈中性故酸过量,则HA的浓度大于0.2 mol/L;混合液中电荷守恒:c(A-)+ c(OH-)=c(Na+)+ c(H+),溶液呈中性:c(OH-)=c(H+),故c(A-)=c(Na+);(4)③组实验溶质为HA与NaA等浓度的混合液,溶液pH<7呈酸性,故HA的电离程度大于A-的水解程度;该混合溶液中离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-)。
考点:溶液中离子浓度大小关系。
本题难度:困难
2、选择题 在相同温度下,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量
B.电离的程度
C.H+的物质的量浓度
D.CH3COOH的物质的量
参考答案:B
本题解析:A、100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液中含有的醋酸的物质的量相同,中和时所需NaOH的量相同,错误;B、根据浓度对电离平衡的影响规律:越稀越电离,0.01 mol·L-1的醋酸溶液中醋酸电离的程度大于0.1 mol·L-1的醋酸溶液中醋酸的电离程度,正确;C、H+的物质的量浓度:前者小于后者,错误;D、两份溶液中CH3COOH的物质的量相等,错误。
本题难度:一般
3、选择题 下列关于电离平衡常数(K)的说法中正确的是
A.电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3
参考答案:A
本题解析:A、电离平衡常数(K)越小,表示弱电解质电离能力越弱,正确;B、电离平衡常数(K)与温度有关,错误;C、电离平衡常数(K)只与温度有关,与浓度无关,错误;D、多元弱酸各步电离平衡常数相互关系为:K1>K2>K3,错误。
本题难度:一般
4、填空题 (8分)常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3·H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是 。
(4)取10mL⑤的溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.
参考答案:(1)①③(2分)
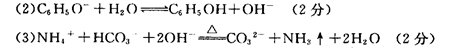
(4)10—12(2分)
本题解析:略
本题难度:一般
5、填空题 (14分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦HCl ⑧NaOH ⑨Cl2 ⑩酒精 请按要求回答下列问题(填编号):
(1) 属于电解质的有 ? ;(2)属于非电解质的有: ? ? ;
(3)属于强电解质的有?;(4)属于弱电解质的有?;
(5)请分别写出NH3·H2O ,NaHCO3的电离方程式:?;???。
参考答案:(共14分)
(1) ①②③⑤⑥⑦⑧?(2)④⑩?(3)①②⑤⑦⑧?(4)③⑥? (各2分)
(5)NH3·H2O 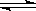 ?NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
?NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
本题解析:(1) 属于电解质的有 ①②③⑤⑥⑦⑧ ;(2)属于非电解质的有:④⑩;
(3)属于强电解质的有①②⑤⑦⑧;(4)属于弱电解质的有③⑥;
(5)NH3·H2O的电离方程式:NH3·H2O 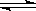 ?NH4 ++OH-;?
?NH4 ++OH-;?
NaHCO3的电离方程式?NaHCO3=Na ++ HCO3-。
点评:水溶液中或熔融状态下能够电离的化合物称为电解质,常见的酸、碱、盐都是电解质如:碳酸、硫酸、硝酸、磷酸、乙酸(醋酸)都是酸,氢氧化钡、一水合氨、氢氧化铜都是碱,碳酸钠、碳酸钙、碳酸氢钠、硫酸铜晶体都是盐,它们都是电解质。在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质。(大多数的有机物都是非电解质)(单质,混合物不管在水溶液中或熔融状态下是否[1]能够导电,都不是电解质或非电解质。)
在水溶液中几乎完全发生电离的电解质叫做强电解质;在水溶液中不完全发生电离的电解质叫做弱电解质。
电解质与非电解质的区别
?
电解质
非电解质
相同点
均为化合物
不同点
水溶液或熔融状态能导电
水溶液和熔融状态都不能导电
本质区别
在水溶液里或熔融状态下自身能发生电离
在水溶液里或熔融状态下自身不能发生电离
所含物质类型
酸, 碱, 盐 , 活泼金属氧化物,水
非金属氧化物,非酸性气态化合物,部分有机物
电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等。凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等。
能导电的化合物不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素。例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。硫酸钡难溶于水,溶液中离子浓度很小,其水溶液不导电,似乎为非电解质。但熔融的硫酸钡却可以导电。因此,硫酸钡是电解质。碳酸钙和硫酸钡具有相类似的情况,也是电解质。从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,但溶的那部分是完全电离的,所以也是电解质。因为溶解是绝对的,不溶是相对的。没有绝对不溶的物质。
本题难度:一般