微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某学习小组对教材实验“在200mL烧杯中放人20 g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。




 (1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
 同学们由上述现象推测出下列结论:?
同学们由上述现象推测出下列结论:?
 ①浓硫酸具有强氧化性? ②浓硫酸具有吸水性? ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性?
①浓硫酸具有强氧化性? ②浓硫酸具有吸水性? ③蔗糖炭化得到的碳连成整体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性?
 其中依据不充分的是?(填序号);?
其中依据不充分的是?(填序号);?
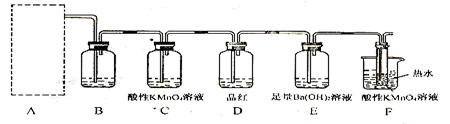
 (2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:?
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:?

 试回答下列问题:
试回答下列问题:
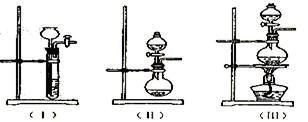
 ①上图A中应选用下列装置?(填编号)。
①上图A中应选用下列装置?(填编号)。

 ②B装置所装试剂是?;D装置中试剂的作用是?
②B装置所装试剂是?;D装置中试剂的作用是?
 ?;E装置中发生的现象是?;
?;E装置中发生的现象是?;
 ③A装置中使蔗糖变黑的化学反应方程式为?;
③A装置中使蔗糖变黑的化学反应方程式为?;
 ④F装置中酸性高锰酸钾溶液颜色变浅的原因是?
④F装置中酸性高锰酸钾溶液颜色变浅的原因是?
 ?;其反应的离子方程式是?。
?;其反应的离子方程式是?。
参考答案:(1)②④ (2)①Ⅱ ②品红溶液或溴水溶液?检验SO2是否被除尽?溶液变浑浊

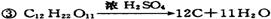
 ?④CO气体能还原热的酸性高锰酸钾? 5CO+6H++2MnO4-
?④CO气体能还原热的酸性高锰酸钾? 5CO+6H++2MnO4- 5CO2↑ +2Mn2++3H2O
5CO2↑ +2Mn2++3H2O
本题解析: (1)浓硫酸使蔗糖炭化表现是浓硫酸的强氧化性和脱水性。(2)虚线框A应是浓硫酸使蔗糖炭化的装置,不需加热,炭化时蔗糖的体积会膨胀,故选Ⅱ装置。产生的气体有:CO2、SO2、CO,检验CO2之前应先检验并除去SO2。
(1)浓硫酸使蔗糖炭化表现是浓硫酸的强氧化性和脱水性。(2)虚线框A应是浓硫酸使蔗糖炭化的装置,不需加热,炭化时蔗糖的体积会膨胀,故选Ⅱ装置。产生的气体有:CO2、SO2、CO,检验CO2之前应先检验并除去SO2。
本题难度:一般
2、选择题 在饱和H2S溶液中,加入或通入下列试剂,既能使pH升高,又能使c(S2-)降低的是……( )
A.溴水
B.通入SO2
C.Cu(NO3)2溶液
D.KAlO2溶液
参考答案:B
本题解析:H2S溶液中通入SO2后发生反应:
SO2+2H2S=3S↓+2H2O
溶液酸性减弱,pH增大,c(S2-)减小。
注意:选项C,反应后生成CuS沉淀和HNO3,虽然c(S2-)减小,但酸性增强pH减小;选项D中,AlO2-水解呈碱性,pH增大,但c(S2-)也增大。
本题难度:一般
3、选择题 造成光化学烟雾的有害气体主要是
A.CO2、碳氢化合物
B.NO和NO2
C.SO2
D.CO2
参考答案:B
本题解析:分析:CO2、碳氢化合物对大气的污染主要是形成温室效应;光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的;二氧化硫气体是酸雨形成的主要原因.
解答:造成光化学烟雾的有害气体主要是汽车排放的尾气中的氮氧化物发生复杂的变化后形成的,故B正确.
点评:本题主要考查污染空气的几种效应和现象,重点了解引起污染的原因和物质.
本题难度:简单
4、实验题 为验证木炭可被浓硫酸氧化成二氧化碳,选用下图中仪器(含所盛物质)组装成套实验装置,试完成下列问题。?
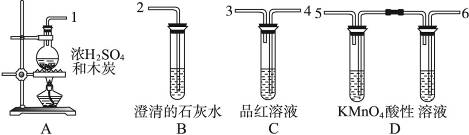
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应该是____________接____________,____________接____________,____________接____________。?
(2)试管B、C中各有什么现象,才能表示已检出二氧化碳??
B中_________________________________,C中__________________________________。?
(3)试管D中能否用饱和NaHCO3溶液代替KMnO4酸性溶液?说明理由。
参考答案:(1)1 6 5 4 3 2
(2)澄清石灰水变浑浊 品红溶液不褪色
(3)不能。NaHCO3虽能除去SO2,但同时生成CO2,这样,使澄清石灰水变浑浊的CO2从何而来,不得而知。
本题解析:A中产生SO2和CO2:
C+2H2SO4 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
CO2能使澄清石灰水变浑浊,因此可用B装置检验是否有CO2生成;但SO2也能使澄清石灰水变浑浊,所以在将CO2通入B中前须除去SO2,除去SO2可用D?装置:?
2KMnO4+2H2O+5SO2====K2SO4+2MnSO4+2H2SO4
D装置是否将SO2气体除净了呢?可用C装置检验:若从D出来的气体不能使品红溶液褪色,则表明SO2已在D中被除净,这样B中澄清石灰水变浑浊,可确证有CO2生成。
本题难度:简单
5、推断题 (15分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
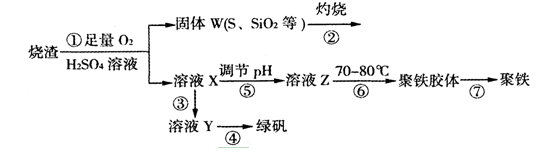
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是?;
A.品红溶液?B.紫色石蕊溶液? C.酸性KMnO4溶液?D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:?;
(3)过程③中,需加入的物质是?;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有?;
(5)过程⑤调节pH可选用下列试剂中的?(填选项序号);
A.稀硫酸? B.CaCO3? C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是?;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为?。(假设杂质中不含铁元素和硫元素)。
参考答案:(1)ACD ?(2)4FeS+3O2 + 12H+= 4Fe3++6H2O+4S (3)Fe(或铁)?(4)蒸发皿、玻璃棒?
(5)C(6)促进Fe3+的水解?(7)31.1%
本题解析:(1)固体W中含有S、SiO2,将其灼烧。其中的S会变为SO2气体,SO2气体有漂白性,能使品红溶液褪色,SO2气体有还原性,能使酸性KMnO4溶液或溴水因发生氧化反应反应而褪色,但是使紫色石蕊试液变为红色。因此选项为A、C、D。(2)过程①中,根据框图中的各种物质及质量守恒定律和电子守恒、电荷守恒可知:FeS和O2、H2SO4反应的离子方程式为4FeS+3O2 + 12H+= 4Fe3++6H2O+4S。(3)由于发生反应得到的物质中含有Fe3+.,而最后要制取绿矾FeSO4,所以过程③中,要加入还原剂Fe粉。(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒。(5)过程⑤调节pH,使溶液的pH增大,应该加入碱,排除A,而若加入CaCO3,会消耗酸,但是引入的杂质离子Ca2+不容易除去,因此可选用下列试剂中的NaOH。选项为C。(6)过程⑥中,将溶液Z加热到70一80℃,目的是促进Fe3+的水解使迅速产生聚铁。(7)n(SO42-)=3.495g÷233g/mol=0.015mol。n(Fe)= n(SO42-)= 0.015mol,所以m(Fe)=0.015mol×56g/mol=0.84g,所以该聚铁样品中铁元素的质量分数为(0.84g÷ 2.700g)×100%=31.1%。2的性质、离子方程式的书写、化学实验基本操作及元素的质量分数的计算的知识。
本题难度:一般