| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题特训(2017年最新版)(四)
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 |
参考答案:
Ⅰ:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
Ⅱ:
【小题1】Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊 应加入少量H2SO4 【小题2】2Al3++3S2-+6H2O = 2Al(OH)3↓+3H2S↑
III:
【小题1】溶液由浅绿色变为紫红色,且半分钟后不变则达到滴定终
【小题2】C
【小题3】ABDE
【小题4】50%
本题解析:Ⅰ:考查反应热的计算和热化学方程式的书写。反应热就是断键吸收的能量和相差化学键放出的能量的差值。因此该反应的反应热为3×436kJ/mol+9466kJ/mol-2×3×3916kJ/mol=-926kJ/mol,因此反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1。
Ⅱ:硫酸铜属于强酸弱碱盐,在溶液中铜离子水解生成氢氧化铜和硫酸。因为水解是吸热的,加热促使水解平衡向正反应方向移动,生成氢氧化铜沉淀,所以溶液会产生混浊。要想不产生混浊,则必须抑制铜离子的水解,因为水解显酸性,所以可以加入少量硫酸以抑制水解。
III:考查基本实验操作和有关计算。
(1)因为高锰酸钾溶液是显紫红色的,当溶液中的亚铁离子被完全氧化生成铁离子后,如果再加一滴酸性高锰酸钾溶液,则溶液的颜色将显紫红色,据此可判断终点。
(2)选项A中相当于稀释了标准液,则消耗标准液的体积将偏大,测定结果偏高。锥形瓶在滴定实验中是不允许用标准液润洗的,B的操作是正确的。滴定管的刻度自上而下是逐渐增大的,滴定前平视,读数不影响。滴定到终点后俯视,则读数将偏低,因此消耗的标准液体积偏低,测定结果偏低。选项D中相当于把这一滴液体计算到标准液中,实验测定结果偏高。
(3)样品需要称量和溶解并配制溶液,所以A、B、D均需要。酸性高锰酸钾溶液具有强氧化性,需要放在酸式滴定管中,D需要。
(4)根据实验可知消耗高锰酸钾是10.00ml,根据方程式可知10.0ml待测液中硫酸亚铁的物质的量是5×0.01L×0.1mol/L=0.005mol。所以FeSO4的质量分数为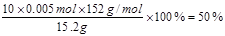 。
。
本题难度:困难
3、选择题 常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:B
本题解析:CH3COOH与NaOH的物质的量之比为2:1,设均为10L,则它们的物质的量分别为2mol和1mol,则混合后,溶液中的溶质为1mol的CH3COOH与1mol的CH3COONa,由于溶液的pH<7,即溶液以醋酸的电离为主,醋酸根离子的水解更弱;所以
A错,溶液中由水电离产生的H+浓度小于1×10-7 mol/L;B正确,c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L;C错,溶液中CH3COOH的电离程度大于CH3COONa的水解程度;D错,溶液中离子浓度的大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
本题难度:一般
4、选择题 在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是( )
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C.c(Na+)=c(HCO3-)>c(OH-)>c(H+)
D.c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
参考答案:B
本题解析:由于碳酸氢钠的水解程度大于电离程度,所以碳酸氢钠溶液显碱性,A和C都不正确;B正确,符合电荷守恒定律;D不正确,不符合物料守恒,应该是c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),答案选B。
考点:考查溶液中离子浓度大小比较
点评:在判断溶液中离子浓度时,需要注意几个关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:困难
5、选择题 下列说法正确的是
A.酸式盐的水溶液一定显碱性
B.醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等
C.NaHSO3溶液的PH大于Na2SO4溶液的PH
D.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
参考答案:B
本题解析:
试题解析:一般弱酸的酸式强碱盐水溶液呈碱性,但也有显酸性的,如NaHSO3、NaH2PO4;另外强酸酸式盐水溶液显酸性,如NaHSO4,故A项错;溶液酸碱性取决于溶液中氢离子和氢氧根浓度的相对大小,氢离子浓度等于氢氧根浓度时,溶液呈中性,故B正确;NaHSO3属强碱弱酸盐,水解显酸性pH<7,Na2SO4属强酸强碱盐不水解,溶液显中性pH=7,故C错误;若反应生成的盐能水解,则中和后溶液不一定显中性,故D错误。
考点:溶液的酸碱性
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《硫及其化合.. | |