微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
_?蓝色?黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴?
⑵?。
参考答案:⑴?加硝酸银溶液?⑵?加水稀释
本题解析:欲使溶液由黄色变成黄绿色或蓝色,则应该使平衡向逆反应方向移动,所以可以加入硝酸银溶液生成氯化银沉淀,降低氯离子浓度;或者加水稀释,促使平衡向逆反应方向移动。
本题难度:一般
2、选择题 一定条件下存在反应:A(g)+B(g) C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中A的物质的量比容器Ⅱ中的多
D.容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1
参考答案:CD
本题解析:在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,反应是从正、逆两个反应方向发生。当反应达到平衡时各组分的含量相同。为同一平衡状态。但是正反应是放热反应,而逆反应为吸热反应,由于反应放出的热量不同,所以反应速率不同。错误。B.容器Ⅲ中由于反应物浓度大,化学平衡正向移动,放热更多。由于温度不同,所以这两个容器的反应的平衡常数不相同。错误。C.由于容器Ⅰ的正反应为放热反应。随着反应的进行,反应的温度升高。而升高温度,化学平衡向逆反应方向移动。因此容器Ⅰ中A的物质的量比容器Ⅱ中的多。正确。D.容器Ⅰ中反应是从正反应方向开始的,容器Ⅱ中是反应是从逆反应方向开始的。由于恒容绝热(与外界没有热量交换),所以A的转化率与容器Ⅱ中C的转化率之和必然小于1。正确。
本题难度:一般
3、选择题 在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知2V(B)=3V(A),3V(C)=2V(B)。则此反应可表示为
[? ]
A.A+3B=2C
B.2A+3B=2C
C.3A+B=2C
D.A+B=C
参考答案:B
本题解析:
本题难度:简单
4、选择题 已知某化学反应的平衡常数表达式为K=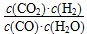 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 1.67
| 1.11
| 1.00
| 0.60
| 0.38
|
下列有关叙述不正确的是
A.该反应的化学方程式是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式: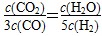 ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
参考答案:C
本题解析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以关键平衡常数的表达式可知,反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g),A正确;随着温度的升高,平衡常数是减小的,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,B正确;CO为0.4 mol,则水蒸气也是0.4mol,CO2和氢气都是0.6mol,则此时
CO2(g)+H2(g),A正确;随着温度的升高,平衡常数是减小的,这说明升高温度平衡向逆反应方向进行,所以正反应是放热反应,B正确;CO为0.4 mol,则水蒸气也是0.4mol,CO2和氢气都是0.6mol,则此时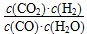 =
=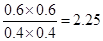 >1.00,所以没有达到平衡状态,C不正确;将
>1.00,所以没有达到平衡状态,C不正确;将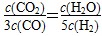 带入平衡常数表达式可得K=0.6,所以温度是1000℃,D正确,答案选C。
带入平衡常数表达式可得K=0.6,所以温度是1000℃,D正确,答案选C。
点评:在判断外界条件对平衡状态的影响时,应该利用勒夏特列原理进行。
本题难度:一般
5、选择题 对于反应:N2+3H2 2NH3(正反应为放热反应),下列图象所示不正确的是(?)
2NH3(正反应为放热反应),下列图象所示不正确的是(?)
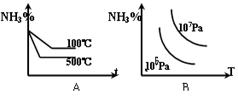
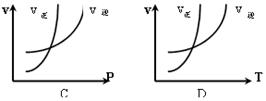
w.k.
参考答案:D
本题解析:略
本题难度:简单