微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)正常人血液中葡萄糖(简称血糖)为3.61~ 6.11(单位:mmol·.L―1),测得某人血液中血糖的质量分数0.1%,已知葡萄糖的相对分子质量为180设血液密度为1g·cm―3,通过计算判定某人血糖指标是多少?某人血糖是否正常?
参考答案:(1)? 5.56 m mol/L?;?正常?;
本题解析:略
本题难度:简单
2、选择题 若以μ表示水的摩尔质量,V表示在标准状况下水蒸气的摩尔体积,ρ为在标准状况下水的密度,NA为阿伏加德罗常数,
m、Δ分别表示每个水分子的质量和体积,下面是四个关系式:①NA="Vρ/m?" ②ρ=μ/(NAΔ)? ③m=μ/NA? ④Δ="V/" NA,其中(? )
A.①和②都是正确的
B.①和③都是正确的
C.③和④都是正确的
D.①和④都是正确的
参考答案:B
本题解析:本题考查以物质的量为中心,摩尔质量、摩尔体积、密度、质量等量之间关系的字母题。由在标准状况下水的密度为ρ、水蒸气的摩尔体积为V,可知水的摩尔质量为ρV=μ,每个水分子的质量m,NA个水分子的质量为m·NA,由此可得m·NA=ρV=μ,推出①③正确;②④两式混淆了水在标准状况下的状态为液体,认为一个水分子的体积为Δ,NA个水分子的体积为NAΔ=V,从而推出错误的关系式②④。
本题难度:简单
3、计算题 4.8 g镁与200 mL稀硫酸完全反应(反应前后溶液体积的变化忽略不计)。求产生的气体在标准状况下的体积和所得溶液中镁离子的物质的量浓度。
参考答案:H2? 4.48L(2分)? c(Mg2+)=" 1mol/L" (2分)
本题解析:略
本题难度:一般
4、计算题 含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
装置
| A(试管+粉末)
| B
| C
|
反应前
| 42.0 g
| 75.0 g
| 140.0 g
|
反应后
| 37.0 g
| 79.0 g
| 140.5 g
|
?

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式。
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4 + 4C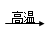 Na2S + 4CO↑?②Na2SO4 + 4CO
Na2S + 4CO↑?②Na2SO4 + 4CO Na2S + 4CO2?
Na2S + 4CO2?
a.若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量。
b.硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量。
参考答案:(1) ① 20%?②80%?(各2分,共4分)
(2)8.8 g?;40.6g?(各2分,共4分)
(3)4CuSO4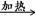 4CuO + 2SO3↑+ 2SO2↑+ O2↑?(2分)
4CuO + 2SO3↑+ 2SO2↑+ O2↑?(2分)
(4) a.0.5 < n(Na2S)<1?(2分)
b.n(Na2S)="0.15" mol?;n(Na2SO3)="0.05" mol ;n(Na2SO4)="0.01" mol
n(H2O)="1.35" mol?(合理即给分。各1分,共4分)
本题解析:(1)①根据化学式CuFeS2可知,该化合物中铜和硫的质量之比是64:64=1:1,所以该矿石含铜的质量分数等于硫的质量分数,都是20%。
②消耗单质碘的物质的量是0.05mol/L×0.020mol/L=0.0010mol,则根据方程式I2+SO2+2H2O=H2SO4+2HI可知,10ml溶液中含有SO2的物质的量是0.010mol,所以生成的SO2的物质的量是0.0010mol×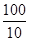 =0.0100mol,所以根据硫原子守恒可知,CuFeS2的物质的量是0.0100mol÷2=0.0050mol,其质量=0.0050mol×184g/mol=0.82g,所以该黄铜矿的纯度
=0.0100mol,所以根据硫原子守恒可知,CuFeS2的物质的量是0.0100mol÷2=0.0050mol,其质量=0.0050mol×184g/mol=0.82g,所以该黄铜矿的纯度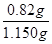 ×80%=80%。
×80%=80%。
(2)生成单质S的物质的量是3.2g÷32g/mol=0.1mol。反应中如果铁离子不足,则根据关系式2Fe3+~S可知,铁离子的物质的量是0.2mol,因此氧化铁的物质的量是0.1mol,其中质量是160g/mol×0.1mol=16g,因此FeS的质量是56.6g-16g=40.6g;如果反应中铁离子过量,则根据硫原子守恒可知,FeS的物质的量是0.1mol,质量是0.1mol×88g/mol=8.8g。
(3)硫酸铜的物质的量=10.0g÷160g/mol=0.0625mol。试管A的质量是42.0g-10.0g=32.0g,所以反应后生成的氧化铜的质量是37.0g-32.0g=5.0g,物质的量是5.0g÷80g/mol=0.0625mol。则生成物SO2、三氧化硫和氧气质量之和是10.0g-5.0g=5.0g。B和C装置是吸收SO2和三氧化硫的,因此二者的质量之和是4.5g,所以氧气的质量是5.0g-4.5g=0.5g,其物质的量是0.5g÷32g/mol=? 0.015625mol。设SO2和三氧化硫的物质的量分别是x和y,则x+y=0.0625mol、64x+80y=4.5g,解得x=y=0.03125mol,所以氧化铜、SO2、三氧化硫和氧气的物质的量之比是4:2:2:1,因此该反应的化学方程式是4CuSO4 4CuO + 2SO3↑+ 2SO2↑+ O2↑。
4CuO + 2SO3↑+ 2SO2↑+ O2↑。
(4)a.若反应中生成的气体只有CO,则根据反应①可知,生成的硫化钠物质的量=2mol÷4=0.5mol;若反应中生成的气体只有CO2,则根据反应①②可知Na2SO4 + 2C Na2S + 2CO2↑,所以生成的硫化钠物质的量=2mol÷2=1mol,因此硫化钠的物质的量是0.5 < n(Na2S)<1。
Na2S + 2CO2↑,所以生成的硫化钠物质的量=2mol÷2=1mol,因此硫化钠的物质的量是0.5 < n(Na2S)<1。
b.在滤液中加入足量的BaCl2后过滤得2.33g沉淀,该白色沉淀是硫酸钡,其物质的量是2.33g÷233g/mol=0.01mol,因此根据原子守恒可知,硫酸钠的物质的量是0.01mol。4.8g沉淀是S,其物质的量是4.8g÷32g/mol=0.15mol,则根据方程式2Na2S+Na2SO3+6HCl=6NaCl+3S↓+3H2O可知,硫化钠和亚硫酸钠的物质的量分别是0.10mol和0.05mol。1.12L H2S 气体的物质的量=1.12L÷22.4L/mol=0.05mol,所以根据方程式Na2S+2HCl=6NaCl+H2S↑可知,硫化钠的物质的量=0.05mol,因此硫化钠的物质的量共计=0.15mol。因此结晶水的质量=43.72g-0.15mol×78g/mol-0.05mol×126g/mol-0.01mol×142g/mol=24.3g,所以结晶水的物质的量=24.3g÷18g/mol=1.35mol。
本题难度:困难
5、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是 ()
A.标准状况下,2.24 L 水中所含的电子数为NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2晶体中所含的离子数为0.4NA
D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA