微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将 Al、CuO、Fe2O3组成的混合物共10.0 g放入50 mL稀硫酸中,混合物完全溶解,当再加入50 mL 2.00 mol/L的NaOH溶液时,得到沉淀最多。上述硫酸溶液的浓度为
A.0.500 mol/L
B.1. 00 mol/L
C.2. 00 mol/L
D.3. 00 mol/L
参考答案:B
本题解析:得到沉淀最大量的时候说明Al3+、Cu2+、Fe3+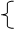 离子全部沉淀,溶液中的阳离子只有Na+,阴离子只有SO42-,根据Na+守恒,可知n(SO42-)=0.05mol,所以硫酸的浓度为1mol/L。答案选B。
离子全部沉淀,溶液中的阳离子只有Na+,阴离子只有SO42-,根据Na+守恒,可知n(SO42-)=0.05mol,所以硫酸的浓度为1mol/L。答案选B。
点评:本题要用守恒法来解。守恒法在化学计算中非常重要,使得很多计算比较苦难的习题变得简单了。
本题难度:简单
2、计算题 (11分)标况下,盛满HCl的烧瓶倒扣入水中,水充满整个烧瓶,求所得溶液物质的量浓度。
参考答案: ?mol·L-1
?mol·L-1
本题解析:根据公式:cB= ?
?
设烧瓶体积为VL,则n((HCl))=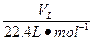
V(溶液)=VL
求得:cB=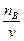
c(HCl)= mol·L-1。
mol·L-1。
本题难度:简单
3、简答题 实验室制配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯?②100mL量筒③1000mL容量瓶?④500mL容量瓶?⑤玻璃棒?⑥试管?⑦药匙
(1)配制时,必须使用的仪器有______(填代号)还缺少的仪器是______.
(2)实验两次用到玻璃棒,其作用分别是:______、______.
(3)配制时,一般可分为以下几个步骤:①称量?②计算?③溶解?④摇匀⑤转移⑥洗涤?⑦定容?⑧冷却.其正确的操作顺序为______.
(4)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
②某同学观察液面的情况如图所示,则所配置的溶液的浓度______.
(5)取出其中50ml溶液加水稀释到100ml,稀释后溶液中NaOH的物质的量浓度为______.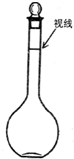
参考答案:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以提供的仪器中必须使用有:①烧杯、④500mL容量瓶、⑤玻璃棒、⑦药匙.
缺失的仪器为:托盘天平、胶头滴管.
故答案为:①④⑤⑦;托盘天平、胶头滴管.
(2)有(1)中溶液配制操作可知,玻璃棒的作用为:搅拌;引流.
故答案为:搅拌;引流.
(3)由(1)中溶液配制操作可知,正确的操作顺序为②①③⑧⑤⑥⑤⑦④.
故答案为:②①③⑧⑤⑥⑤⑦④.
(4)①摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
故答案为:偏低.
②由图可知定容时俯视刻度线,导致所配溶液体积偏小,所以所配溶液浓度偏高.
故答案为:偏高.
(5)根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后溶液中氢氧化钠的物质的量浓度,设令稀释后NaOH的物质的量浓度为c,则50mL×0.5mol/L=100mL×c,解得:c=0.25mol/L.
故答案为:0.25mol/L.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g
参考答案:C
本题解析:
本题难度:简单
5、选择题 将标准状况下的aL氨气溶于1L水中,得到氨水的密度为bg?cm-3,则该氨水的物质的量浓度为( )
A.
mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:氨气的物质的量=aL22.4L/mol=a22.4mol;
氨气的质量=a22.4mol×17g/mol=17a22.4g;
氨水的体积=(17a22.4+1000)1000bL,则氨水的物质的量浓度=a22.4mol(17a22.4+1000)1000bL=1000ab22400+17amol/L,
故选C.
本题解析:
本题难度:一般