微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是? ( ? )
测定时刻/s
| t1
| t2
| t3
| t4
|
c(A)/(mol/L)
| 6
| 3
| 2
| 2
|
c(B)/(mol/L)
| 5
| 3.5
| 3
| 3
|
c(C)/(mol/L)
| 1
| 2.5
| 3
| 3
|
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
参考答案:D
本题解析:A、在t3时刻达到化学平衡状态,反应并没有停止,化学平衡是动态平衡,A错误;由表格可知A的转化浓度为4mol/L,B的转化浓度为2mol/L,转化浓度除以起始浓度得转化率,A大于B,故B错误;A、B、C三者的转化浓度之比为4mol/L:2mol/L:2mol/L,即2:1:1为化学方程式中的系数比,故C错误;根据浓度变化量除以时间可得D正确;故选D。
本题难度:一般
2、填空题 (12分)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
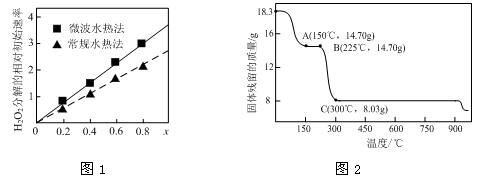
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
参考答案:(1)①+3 ②微波水热 Co2+
(2)① Co3O4(写成CoO·Co2O3亦给分) 3CoC2O4 + 2O2 = Co3O4 +6CO2
②由电子守恒:n(Co3+) =" 2" n(Cl2) =" 0.4" mol(1分)
由电荷守恒:n(Co)总=n(Co2+)溶液=" 0.5" n(Cl-) =" 0.5×(" 2.4mol-0.2mol×2)=" 1" mol
所以固体中的n(Co2+)= 1mol-0.4mol=" 0.6" mol(1分)
n(O)=(0.4mol×3+0.6mol×2)÷2=1.2mol(1分)
故n(Co):n(O)=1mol:1.2mol=5:6(1分)
(除第(1)②小题每空1分,第(2)②小题4分外,其余每空2分,共12分)
本题解析:(1)①该催化剂中Co、Ni均为+2价,O为-2价,所以Fe元素的化合价是[8-(2x+2-2x)]/2=+3;
②反应速率越快,则催化剂的催化活性越高,根据图像可知,x相同时微波水热法初始反应速率大于常规水热法,所以微波水热法制取得到的催化剂活性更高;随x增大,初始速率增大,而x增大,Co2+的比例增大,所以Co2+的催化效果更好;
(2)①由题意知,二水合草酸钴(CoC2O4·2H2O)的起始质量是18.3g,物质的量是0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量是8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g/mol=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1:0.133125=3:4,所以C点对应固体的化学式是Co3O4;B点对应的物质的质量是14.70g,与 起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与O2在225℃~300℃发生反应生成Co3O4和二氧化碳,所以反应的化学方程式是3CoC2O4 + 2O2 = Co3O4 +6CO2;
②设该钴的氧化物中+3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48L/22.4L/mol=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为+2价,则+3价Co得到电子的物质的量是x=0.4,480 mL 5 mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据Cl元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6mol,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4mol×3+0.6mol×2)/2=1.2mol,所以该钴氧化物中Co、O的物质的量之比为1.0:1.2=5:6.
考点:考查元素化合价的判断,物质化学式的计算,得失电子守恒规律的应用
本题难度:困难
3、选择题 已知反应:2SO2(g)+ O2(g)  2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置
于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所
示。则下列说法正确的是
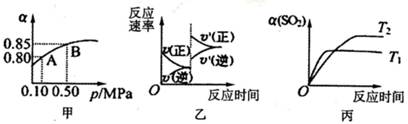
A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>Tl
参考答案:C
本题解析:A、B点SO2的平衡浓度为2×(1-0.85)÷10="0.03" mol·L-1,错误;
B、? 2SO2(g)+ O2(g)  ?2SO3(g)
?2SO3(g)
始量? 2? 1
转化量? 1.6? 0.8? 1.6
平衡量? 0.4? 0.2?1.6
平衡常数k=0.162/0.042×0.02=800,错误。
C、达平衡后,缩小容器容积,增大压强平衡正向移动,正反应速率大于逆反应速率且均比原来大,正确;D、Tl反应速率快,温度高,错误。
本题难度:一般
4、简答题 把0.6mol?X气体和0.6mol?Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g).2min?末,若测知以W?的浓度变化表示的反应速率为0.05mol?L-1?min-1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,计算:
(1)前2min内用Y的浓度变化表示的平均反应速率.
(2)2min末时X的浓度.
(3)化学反应方程式中n的值是多少?
参考答案:(1)速率之比等于化学计量数之比,V(Y)=12v(W)=12×0.05mol?L-1?min-1=0.025mol?L-1?min-1.
故答案为:0.025mol?L-1?min-1.
(2)速率之比等于化学计量数之比,V(X)=v(W)=0.05mol?L-1?min-1,
2mim内X的浓度变化为△c(X)=V(X)?△t=0.05mol?L-1?min-1×2min=0.1mol?L-1,
2min末时X的浓度c(X)=0.6mil2L-0.1mol?L-1=0.2mol?L-1.
故答案为:0.2mol?L-1.
(3)压强之比等于物质的量之比,2min末时容器内气体的总物质的量为(0.6mol+0.6mol)×54=1.5mol,
2min末时容器内X的物质的量为2L×0.2mol?L-1=0.4mol,
? 2X(g)+Y(g)=nM(g)+2W(g)? 物质的量增加
? 2mol?(2+n)-3=n-1
?(0.6-0.4)mol?(1.5-1.2)mol
即:2mol(0.6-0.4)mol=n-1(1.5-1.2)mol,解得:n=4,
故答案为:n=4.
本题解析:
本题难度:一般
5、填空题 某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
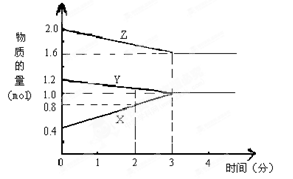
(1)该反应的化学方程式:?;
(2)反应开始至2min末,X的反应速率为?;
(3)该反应是由?开始反应的。(?正反应?逆反应?正逆反应同时。)
参考答案:(1)2Z+Y 3X?(2)0.067mol/(L·min)?(3)③
3X?(2)0.067mol/(L·min)?(3)③
本题解析:(1)由图可知,X的物质的量增加为生成物,Y、Z的物质的量减少为反应物,反应最后反应物的物质的量为定值不为0,是可逆反应。Y、Z、X的物质的量变化量之比为(1.2-1.0)mol:(2.0-1.6)mol:(1.0-0.4)mol=1:2:3,物质的量变化量之比等于化学计量数之比,所以反应方程式为Y+2Z 3X。
3X。
(2)反应速率通常用单位时间内浓度的变化量来表示,则2min内,X的反应速率为v(X)=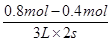 =0.067mol/(L·min)。
=0.067mol/(L·min)。
(3))由图可知,反应开始反应混合物Y、Z、X物质的量分别为1.2mol、2.0mol、0.4mol,所以反应从正逆反应同时开始,因此答案选③。
点评:该题是基础性试题的考查,难度不大。本题以图象为载体考查化学反应速率、化学平衡的建立、读图提取信息能力,结合图像中的信息运用知识解决问题,有利于培养学生的发散思维能力和规范答题能力。
本题难度:一般