微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.升高温度
B.加入少量CuSO4溶液
C.加入适量的水
D.加入浓盐酸
参考答案:A、升高反应体系温度,反应速率增大,不影响生成氢气的总量,故A错误;
B、加入少量CuSO4溶液,锌与硫酸铜反应置换出铜,形成原电池,反应速率加快,因为是过量的锌粉,所以不影响生成的氢气总量,故B错误;
C、加水,加水,氢离子的浓度减小,减缓反应速率,但又不影响生成氢气的总量,故C正确;
D、加浓盐酸,氢离子的浓度增大,加快反应速率,但氢离子的物质的量增多,会影响生成氢气的总量,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)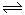 2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
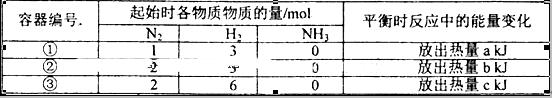
下列叙述正确的是
A.放出热量关系:a<b <92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①> ;③
D.N2的转化率:②>①>③
参考答案:A
本题解析:A、①、②相比,②的氮气的浓度较大,氢气浓度相等,所以②的氢气的转化率高,放出的热量多,但氢气不会完全转化,所以放出的热量都小于92.4kJ,a<b <92.4正确;B、三个容器内反应的温度相同,对于同一反应,温度不变,化学平衡常数不变,错误;C、①、③相比,③的反应物浓度是①的2倍,所以③相当于在①平衡的基础上又正向移动,所以达平衡时氨气的体积分数:①<③,错误;D、由C分析,①、③相比,N2的转化率③>①;①、②相比,②的氮气的浓度较大,氢气浓度相等,根据增大一种反应物的浓度会增大另一种反应物的转化率,而自身转化率降低,所以N2的转化率:①>②,综合起来是③>①>②,错误,答案选A。
本题难度:一般
3、选择题 下列说法不正确的是
[? ]
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应C(s) +CO2(g)=2CO(g)不能自发进行,则该反应的△H >O
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
参考答案:AC
本题解析:
本题难度:一般
4、简答题 一定条件下将8mol?H2和4molCO充入0.5L的密闭容器中,发生如下反应:2H2(g)+CO(g)?

?CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:
(1)用H2表示的化学反应速率.
(2)如果此时将反应所得到的混合物充分燃烧,至少需要标准状况下的氧气多少升?
参考答案:(1)6s内以CH3OH表示化学反应速率为v(CH3OH)=2mol0.5L6s=23mol/(L?s),
由速率之比等于化学计量数之比,所以v(H2)=2v(CH3OH)=2×23mol/(L?s)=43mol/(L?s),
答:用H2表示的化学反应速率为43mol/(L?s);
(2)2H2~O2? ?2CO~O2
?8mol? 4mol? ? 4mol? 2mol
所需氧气体积为(4mol+2mol)×22.4L/mol=13.44L.
答:至少需要标准状况下的氧气13.44L.
本题解析:
本题难度:一般
5、选择题 向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是(?)
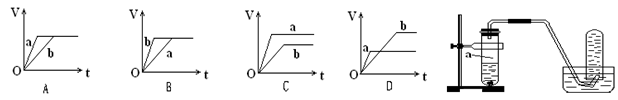
参考答案:B
本题解析:足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,发生反应:Zn+Cu2+=Zn2++Cu,形成原电池,反应速率加快,反应用时少于b,锌粉足量,生成氢气的由硫酸的决定,硫酸等量,产生氢气的体积相同,结合图像知,选B。
本题难度:一般