| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《键参数——键能、键长与键角》试题预测(2017年最新版)(四)
参考答案:(1)F>N>O;V形 (2)sp;2NA 本题解析:(1)由洪特规则的特例可知,氮元素的第一电离能大于氧元素(大于氮元素的“左邻右舍”),小于氟元素;由价层电子对互斥理论可知,OF2分子的空间构型是V形。(2)根据等电子原理,NO22+离子与CO2互为等电子体,两者的结构相似,NO2+离子中氮原子的杂化方式与CO2中碳原子的杂化方式相同,都是sp杂化;O22+与N2(其中有一个σ键和两个π键)互为等电子体,因此O22+中有2个π键。(4)钙在氧气中燃烧所得到的氧化物晶体中Ca2+与O22—的最简个数比为1:1。(5)(6)根据价层电子对互斥理论分析,SO2与O3分子的结构最相似,且都是极性分子。 本题难度:一般 2、选择题 下列分子中属于非极性分子的是(?) 参考答案:C 本题解析:略 本题难度:简单 3、简答题 A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含______个σ键,______个π键; (3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是______.
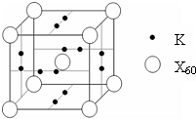 (4)E能与AB形成配合物,其中E提供______,AB提供______. (4)E能与AB形成配合物,其中E提供______,AB提供______.(5)如图所示晶胞中,阳离子与阴离子的个数为______. 参考答案:A、B、C、D四种短周期元素原子序数依次增大,B元素的最外层电子数是其电子层数的3倍,由于最外层电子数不超过8,1个电子层最多容纳2个电子,故B原子有2个电子层,最外层电子数为6,则B为氧元素;A元素原子的价电子排列为ns2np2,处于ⅣA族,原子序数小于氧元素,则A为碳元素;C元素的第三电离能剧增,表现+2价,处于ⅡA,原子序数大于氧元素,故C为Mg元素;D元素的第四电离能剧增,表现+3价,处于ⅢA族,则D为Al元素;E元素原子的价电子排布为3d64s2,核外电子数为26,为Fe元素, 本题解析: 本题难度:简单 4、选择题 下列粒子的结构表示正确的是 参考答案:D 本题解析: 本题难度:简单 5、选择题 三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到的:4NH3+3F2=NF3+3NH4F 。下列有关NF3的叙述正确的是 参考答案:D 本题解析:NF3是共价化合物,A不正确;NF3中氮元素的化合价是+3价,其还原性比NH3弱,B不正确;根据方程式可知,NF3被作还原剂,其氧化性比F2弱,C不正确,所以正确的答案选D。3的有关判断 本题难度:一般 | |||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《化学平衡》.. | |