微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法错误的是(?)
A.附着在试管内壁上的AgCl固体可用氨水溶解而洗去
B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液
C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液
D.加热碘单质,产生紫色碘蒸气,这个过程只克服范德华作用力
参考答案:C
本题解析:氯化银能溶于氨水形成配合物,A正确。氨气能和银离子、铜离子形成配合物,但氨水不能溶解氢氧化铝,所以B正确。C不正确,应该是向硫酸铜溶液中滴加氨水至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液。碘属于分子晶体,升华破坏的是分子间作用力,D正确。所以答案选C。
本题难度:一般
2、选择题 下列说法正确的是
A.电负性最大的原子价电子构型:3S23p5
B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型
C.共价键和离子键都既有方向性又有饱和性
D.根据VSEPR理论判断SF6空间构型为 正八面体
参考答案:D
本题解析:电负性最大的原子是F,价电子构型:2S22p5?A错误
N3-、CO2和O3互为等电子体,只有CO2空间构型都是直线型,其余是V型的, B错误
根据VSEPR理论,S原子以sp3d2杂化轨道形成σ键,分子为正八面体形分子,正确。故选D。
点评:熟练掌握共价键和离子键的特点及 VSEPR理论才能准确处理各种离子,分子的空间构型。
方向性,即要按照一定的方向形成作用力。饱和性,即形成了特定数目的作用力。
离子键:阴离子与阳离子之间的作用力,离子可以看成是均匀的带电小球,所以,既没有方向性,也没有饱和性,即,只要阴离子足够大,就能在表面的各个方向尽可能多的吸引阳离子,反之,阳离子也是这样。
共价键:是原子通过电子云的重叠形成的作用,所以,既有方向性,也有饱和性,即电子云要按照一定的方向重叠,才能保证最大重叠,保证共价键的稳定性,所以导致了分子中的共价键间的键角。另外,原子都有自己特定的成键数目,如H原子只能形成1个共价键,O原子可以形成2个键,即饱和性。
本题难度:简单
3、填空题 有A、B、C、D、E五种元素,它们的核电荷数依次增大.已知:A失去一个电子后就成为一个质子;B有两个电子层,其最外层的电子数是次外层电子数的2倍;C的L层得2个电子后成为稳定结构;D是海水中含量第一位的金属元素;E的最外层电子比次外层电子少一个.请填写下列空格:
(1)A单质的电子式______;BC2的电子式______.
(2)D离子的结构示意图______,D、E结合形成的化合物的电子式______.
(3)B、C、D三种元素可形成一种化合物,其化学式为______.
参考答案:有A、B、C、D、E五种元素,它们的核电荷数依次增大.A失去一个电子后就成为一个质子,则A为氢元素;B有两个电子层,其最外层的电子数是次外层电子数的2倍,最外层电子数为4,则B为碳元素;C的L层得2个电子后成为稳定结构,其L层电子数为8-2=6,则C为氧元素;D是海水中含量第一位的金属元素,则D为Na;E原子序数大于Na,最外层电子比次外层电子少一个,由于最外层电子数不能超过8,故E次外层电子数只能为8,最外层电子数=8-1=7,则E为Cl,
(1)氢气分子中H原子之间形成1对共用电子对,其电子式为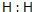 ;CO2分子中C原子与O原子之间形成2对共用电子对,其电子式为
;CO2分子中C原子与O原子之间形成2对共用电子对,其电子式为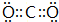 ,
,
故答案为: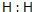 ;
;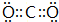 ;
;
(2)Na+离子核外有2个电子层,过程电子数为2、8,离子的结构示意图为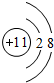 ,Na、Cl结合形成的化合物为NaCl,由钠离子与氯离子过程,其电子式为
,Na、Cl结合形成的化合物为NaCl,由钠离子与氯离子过程,其电子式为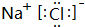 ,故答案为:
,故答案为: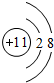 ;
;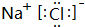 ;
;
(3)C、O、Na三种元素可形成一种化合物,其化学式为Na2CO3,故答案为:Na2CO3.
本题解析:
本题难度:一般
4、选择题 在KMnO4中,Mn的化合价是( ? )
A.+2
B.+4
C.+6
D.+7
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列表述正确的是
[? ]
A.金刚石与12C互为同位素
B.NH3是由非极性键构成的
C.Na+的结构示意图:
D.CCl4的电子式为: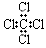
参考答案:C
本题解析:
本题难度:简单