微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_____(填序号,下同),水的电离程度相同的是______。
(2)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
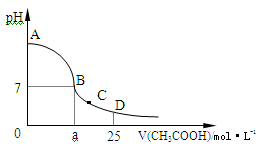
①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
参考答案:(1)⑥,②③④ ;(2)> > > ;(3)>, >;(4)①否 AB ;②c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
本题解析:(1)①②③④是酸或碱对水的电离起抑制作用,⑤NH3·H2O是弱碱,CH3COOH是弱酸,反应后溶液中溶质:CH3COONH4、NH3·H2O,对水的电离抑制,⑥两者恰好完全反应,生成NaCl,对水的电离无影响,所以⑥的水的电离最大,②③④溶液中c(H+)或c(OH-)相等,对水的电离影响相同;(2)①CH3COOH是弱酸,②HCl是强酸,稀释相同倍数,醋酸中的c(H+)小于盐酸中c(H+),pH:①>②;pH=12时,NH3·H2O是弱碱在稀释过程还要电离出一部分OH-,c(OH-)大于氢氧化钠溶液中c(OH-),③>④;⑤反应后溶液显碱性,⑥反应后溶液显中性,⑤>⑥;(3)混合溶液中c(Na+)>c(CN-),说明CN-的水解大HCN的电离,溶液显碱性,①c(OH-)>c(H+),②c(HCN)>c(CN-);(4)①醋酸是弱酸,氢氧化钠是强碱,两者恰好完全反应生成的CH3COONa是强碱弱酸盐,水溶液显碱性,因此这种看法不正确,填写:否,二者恰好完全反应的点在AB区间内;②在C点溶液显酸性,此时的溶质是:CH3COOH、CH3COONa,CH3COOH的电离大于CH3COO-的水解,因此离子浓度由大到小的顺序:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)。
考点:考查弱电解质的电离、离子浓度大小等知识。
本题难度:困难
2、选择题 已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3
电离平衡常数(25℃)
1.8×l0-5
4.9×l0-10
K1=4.3×l0-7
K2=5.6×l0-11
|
根据上述电离常数分析,下列表述不正确的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a?mol/L?HCN溶液与b?mol/L?NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.2?NaCN+H2O+CO2=2?HCN+Na2CO3
D.2CH3COOH+Na2CO3→2?CH3COONa+H2O+CO2↑
参考答案:C
本题解析:
本题难度:一般
3、选择题 在蒸馏水中按物质的量之比为1∶1∶1∶2加入AgNO3,Ba(NO3)2,Na2SO4,NaCl,使之完全溶解,以铂电极电解该混合物至溶质完全反应,则所得氧化产物与还原产物的质量比为(?)
A.35.5∶108
B.71∶2
C.108∶35.5
D.71∶109
参考答案:B
本题解析:
【错解分析】四种物质按一定物质的量之比混合、溶解,用惰性电极进行电解。由于①只是片面考虑溶液中阳离子放电顺序是:银离子、氢离子……等;阴离子放电顺序是:氯离子、氢氧根离子……等。②对题目要求溶质完全反应认可有分歧,因此产生以下两种结论。当电路中转移了1mol电子,银离子完全反应,还原产物为1mol银,氧化产物为1mol氯原子(未电解完),氧化产物与还原产物的质量比为35.5∶108(选项A)。当电路中转移了2mol电子,氯离子完全反应,氧化产物为2mol氯原子,还原产物为1mol银和1mol氢原子(水提供),氧化产物与还原产物的质量比为71∶109(选项D)
【正解】反应,生成难溶的氯化银、硫酸钡和硝酸钠。电解质溶液转化为按物质的量之比为3∶1的NaNO3,NaCl,电解时只有氯离子和氢离子参加电极反应,氧化产物与还原产物的质量比为71∶2。
本题难度:简单
4、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H+?K1=1.75×10-5?△H1>0
CH3COO— + H2O CH3COOH + OH—?K2=5.71×10-10?△H2>0
CH3COOH + OH—?K2=5.71×10-10?△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH<7
C.混合溶液中c(CH3COO—)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小
参考答案:BC
本题解析:A、电离和水解均是吸热的,所以对混合溶液进行微热,K1、K2均增大,A不正确;B、由于醋酸根的水解常数小于醋酸的电离常数,因此二者浓度相同的混合液显酸性,即pH<7,B正确;C、醋酸的电离程度大于醋酸根的水解程度,溶液显酸性,则根据电荷守恒混合溶液中c(CH3COO—)+c(OH—)=c(Na+)+c(H+)可知,混合溶液中c(CH3COO—)>c(Na+),C正确;D、温度不变,若在混合溶液中加入少量NaOH固体,中和氢离子,促进醋酸的电离,所以溶液中c(CH3COO—)增大,D不正确,答案选BC。
本题难度:一般
5、选择题 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线。
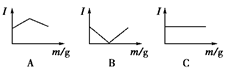
以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量 ②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量 ④NH4Cl溶液中逐渐加入适量NaOH固体
参考答案:D
本题解析:①中生成硫酸钡沉淀和水,所以导电性降低,完全反应后,再加入硫酸,导电性增强,符合B。②中生成强电解质醋酸铵,导电性增强,恰好反应后,再加入氨水,溶液的导电性会下降,所以符合A图。③中先生成碳酸钙沉淀,继续通入CO2,又生成碳酸氢钙,导电性增强,所以符合B图。④中生成弱电解质氨水和强电解质氯化钠,导电性几乎不变,所以符合C图。答案选D。
本题难度:困难