微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B、C、X均为中学常见的物质,它们之间有如下转化关系(其它产物已略去):
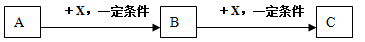
则下列说法不正确的是
A.若A是NH3,则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物一定是强酸
C.若X是金属单质,则B、C中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
参考答案:B
本题解析:A:A 为NH3,X为O2,B为NO,C为NO2;
B: A 为碳单质,X为O2,B为CO,C为CO2,与水反应生成弱酸碳酸;
C:A 为Cl2,X为Fe,B为FeCl3,C为FeCl2;
D:A 为Al3+,,B为Al(OH)3,C为AlO2-;
本题难度:简单
2、实验题 (1)下图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀。
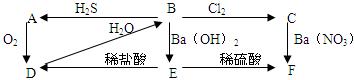
①写出B→C的化学方程式
?
②写出B→A的化学方程式
?
③C→F的离子方程式?
④E→D的离子方程式?
⑤上图中共发生了8个反应(每根箭头一个反应),其中有?个是氧化还原反应;从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强?
(2)把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:

①由此可以推断:A为?;C为??和 ?
②写出D加入F生成E和G的离子方程式?
③C通入澄清石灰水时,若气体通过量则白色沉淀又会溶解,写出白色沉淀溶解的化学方程式?
?
参考答案:(1)①H2O+H2SO3+Cl2=2HCl+H2SO4 (2分)②2H2S+H2SO3=3S+3H2O (2分) ③Ba2++SO42-=BaSO4↓(2分)
④BaSO3+2H+=SO2↑+Ba2++H2O(2分)?⑤(2分)3;H2S+ Cl2=S+2HCl(2分)
(2)①碳(2分);二氧化碳和一氧化氮(2分)?
②3Cu+2NO3-+8H+=3Cu2++4H2O+2NO↑ (2分)
③CaCO3+CO2+H2O=Ca(HCO3)2(2分)
本题解析:略
本题难度:一般
3、填空题 (16分)A、D、E、X、Y是原子序数依次增大的短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用。
(1)Y的离子结构示意图为?。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有??。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键。常温下甲是一种无色液体。
①甲是一种二元弱碱, 写出其一级电离方程式:?。
写出其一级电离方程式:?。
②甲在碱性溶液中能够将CuO还原为Cu2O, 已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
已知每1mol甲参加反应有 4 mol电子转移,该反应的化学方程式为:?。
(4)处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1 g Y固体单质时放出8.4 kJ热量,此反应的热化学方程式为?。
(5)将0.050 mol YX2(g)和0.030 mol X2(g)放入容积为1 L的密闭容器中,反应: X2(g) +2YX 2(g) 2YX3(g)在一定条件下达到平衡。
2YX3(g)在一定条件下达到平衡。
①若其他条件不变,增大体系的压强,平衡常数K?(填“增大”、“减小”或“不变”)。
②平衡时测得c(X2)=0.010 mol·Lˉ1。该条件下反应的平衡常数K=?,YX2的平衡转化率为?。
参考答案:(16分)
(1)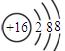 (1分)
(1分)
(2)离子键、共价键(2分)
(3)①N2H4 +H2O N2H5++ OHˉ (2分)
N2H5++ OHˉ (2分)
②N2H4 +4CuO=N2↑+2Cu2O+2H2O?(3分)
(4)2CO(g)+SO2(g)=2CO2(g)+S(s)?ΔH="–268.8" kJ·molˉ1 (3分)
(5)①不变(1分)
②1.6×103 ?80%或0.8(各2分,共4分)
本题解析:略
本题难度:简单
4、填空题 (12分)物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:
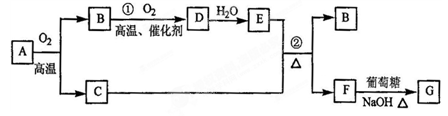
(1)写出下列物质的化学式:B?、E?、G?
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是?,阴极电极材料是?,电解质溶液是?
(3)反应②的化学方程式是?。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K =?(保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度?(填“增大”、“不变”或“减小”),
氧气的转化率?(填“升高”、“不变”或“降低”),
D的体积分数?(填“增大”、“不变”或“减小”)。
参考答案:(1) SO2?H2SO4?Cu2O
(2)粗铜?精铜? CuSO4溶液
(3)Cu+2H2SO4(浓)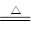 ?CuSO4+SO2↑+2H2O
?CuSO4+SO2↑+2H2O
(4)23.8?减小?降低?减小
本题解析:本题是无机框图题,根据是杂质突破点。G为砖红色沉淀,即G是氧化亚铜,则F是氢氧化铜,所以C是铜,E是硫酸。因此D是三氧化硫,B是SO2,这说明A含有铜和硫元素。
(2)粗铜精炼是,阳极是粗铜,阴极是纯铜,电解质是硫酸铜。
(3)在加热的条件下,浓硫酸和铜反应生成硫酸铜、SO2和水,方程式为
Cu+2H2SO4(浓)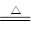 ?CuSO4+SO2↑+2H2O。
?CuSO4+SO2↑+2H2O。
(4)反应①的方程式为2SO2+O2 2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为
2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为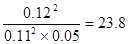 。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为
。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为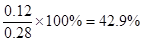 。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为
。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为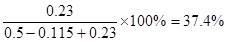 ,所以三氧化硫的体积分数减小。
,所以三氧化硫的体积分数减小。
本题难度:一般
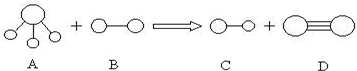
5、填空题 组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如图所示的反应.其中A的水溶液能使酚酞试夜变红,组成B的元素的电负性在周期表中最大.请写出A、B、C、D的化学式:
A______;B______;C______;D______.
参考答案:A的水溶液能使酚酞试夜变红,结合A的结构模型可知A为NH3,组成B的元素的电负性在周期表中最大,则B为F元素组成的单质,为F2,结合生成物的结构模型可知生成C为HF,D为N2,发生反应的方程式为2NH3+3F2=6HF+N2,
故答案为:NH3;F2;HF;N2.
本题解析:
本题难度:一般