微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BN,如下图所示:?

Ⅰ.由H3BO3制备B2O3的化学方程式是_________;
Ⅱ.某实验小组利用上述反应原理(B2O3?+?2NH3? 2BN?+?3H2O)和如下装置制备氮化硼。
2BN?+?3H2O)和如下装置制备氮化硼。

已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水。 ?
(1)连接好装置后,在各连接处涂抹肥皂水,然后通入N2检查气密性。证明气密性良好的现象是_____________;通入N2的另一作用是______________。
(2)瓶B中装有硫酸溶液,作用是_____________。
(3)反应结束时,关闭电炉和活塞K,并立即用弹簧夹夹紧A、B之间的橡皮管,直至___________再转移产物。若没有夹紧橡皮管可能观察到的现象是__________。
(4)欲除去产物中未反应的B2O3并得到纯净的BN固体,实验操作过程是__________。
参考答案:Ⅰ.2H3BO3 B2O3+ 3H2O
B2O3+ 3H2O
Ⅱ.(1)各连接处均无泡沫产生;?除去装置中的氧气
(2)吸收未反应的氨气
(3)装置冷却至室温 ;?瓶B中的稀硫酸倒吸入瓶A中(或其他合理答案)
(4)将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干
本题解析:
本题难度:一般
2、实验题 某中学化学兴趣小组用含有铁铝合金的工业废料,制备FeSO4·7H2O和硫酸铝晶体。具体实验操作步骤如下:
① 将5%Na2CO3溶液加入到盛有一定量废合金的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废合金用蒸馏水洗涤2至3遍;
② 取洗涤后废合金,加入足量的NaOH溶液中,反应完全后过滤;
③ 向滤液中边搅拌边滴加稀硫酸至溶液的pH为8—9,静置,过滤,洗涤;
④ 将③中固体溶于足量的稀硫酸,将得到的溶液蒸发浓缩,冷却,结晶,过滤,干燥,得到硫酸铝晶体;
⑤ 将②得到的固体洗涤后加入过量的稀硫酸,至铁溶解完全;
⑥ 将得到的溶液转入密闭容器中,静置,冷却结晶;
⑦ 待结晶完毕后,滤出晶体,用少量冰水洗涤2至3次,再用滤纸将晶体吸干,得到FeSO4·7H2O晶体。 (1)实验步骤①的目的是_____________ 。
(2)步骤②发生的离子反应方程式为___________ 。
(3)步骤③中,溶液中pH难控制,可改用_____________ 。
(4) 步骤⑤明显不合理,理由是 _________________。
(5)用少量冰水洗晶体,其目的是 __________________。
(6)FeSO4·7H2O晶体在高温下可以分解生成Fe2O3,SO2和H2SO4,写出该反应的化学方程式_____________ 。
参考答案:(1)除去油污
(2)2Al + 2OH-+6H2O = 2[Al(OH)4]-+ 3H2 ↑
(3)通入CO2气体
(4)应该Fe过量,否则溶液中可能有Fe3+
(5)洗涤除去晶体表面附着的硫酸等杂质
(6)2FeSO4·7H2O == Fe2O3+SO2↑+ H2SO4+13H2O
本题解析:
本题难度:一般
3、简答题 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:
(1)写出试管a中发生的化学方程式:______.
(2)试管b中所盛的溶液为______,其主要作用是______.
(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是______.
(4)该实验中,若用3mol乙醇和1mol乙酸
在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?______(填“能”或“不能”),原因是______(不考虑原料损耗).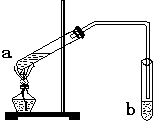
参考答案:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,故答案为:CH3COOH+C2H5OH浓硫酸
本题解析:
本题难度:一般
4、实验题 硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下

请回答下列问题:
(1)确定锌镀层被除去的标志是________________;计算上述铁片锌镀层的厚度,不需要的数据是____________?(填编号)。
a.锌的密度ρ(g/cm3)?b.镀锌铁片质量m1(g)?
c.纯铁片质量m2(g)? d.镀锌铁片面积S(cm2)?e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、______、_______?、称量。
(3)A物质可以为_______?(填编号)。
a.CuCl2?b.CuO?c.Cu(NO3)2?d.CuSO4?
? (4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是____________。
(5)鉴定所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法正确的是_________?(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
参考答案:(1)反应速率突然减小(或铁片表面生成的气泡突然减少);e?
(2)洗涤、烘干(或干燥)
(3)bd
(4)避免加热过程中晶体受热分解(或被氧化)
(5)bcd
本题解析:
本题难度:一般
5、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】方法:按照下图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。

(1)最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:____________________________ 。
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(2)甲同学查阅资料后,得到Fe(OH)2如下信息:?

阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(3)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(4)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿 91EXAM.org”的现象进行合理解释的实验设计新思路。___________________________________ 。
参考答案:(1)B;Fe+H2SO4=FeSO4+H2↑.FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.H2SO4+2NaOH=Na2SO4+2H2O (中和反应方程式不写不扣分)
(2)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO·Fe2O3·4H2O
(3)打开;发生;Fe(OH)2·nH2O= Fe(OH)2+ nH2O
(4)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)
本题解析:
本题难度:一般