微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验原理、方法和结论都正确的是
[? ]
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有
Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3-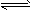 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4
中的溶解度比在水中的大
参考答案:C
本题解析:
本题难度:一般
2、实验题 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
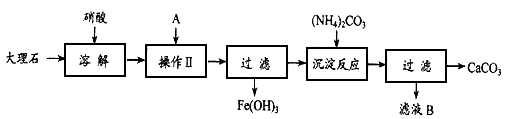
(1)溶解大理石时,用硝酸而不同硫酸的原因是____________ 。
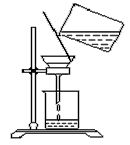
(2)过滤时,某学生的操作如下图:请指出图中的错误是_______________。
(3)检验滤液中是否含铁,选用的试剂是________,现象________,反应的离子方程式:__________。
(4)写出加入碳酸铵所发生反应的离子方程式:_____________ 。
参考答案:(1)硫酸钙微溶于水
(2)玻璃棒下端没有(或应该)靠在(三层)滤纸上;漏斗颈没有(或应该)靠在烧杯内壁;
(3)硫氰化钾溶液(或KSCN);溶液呈血红色; Fe3++3SCN-==Fe(SCN)3
(4)Ca2++CO32-==CaCO3↓
本题解析:
本题难度:一般
3、实验题 TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。某学习小组同学在实验室用钛铁矿精矿(主要成分为FeTiO3及少量SiO2等杂质)模拟工业生产TiO2,?设计流程如下
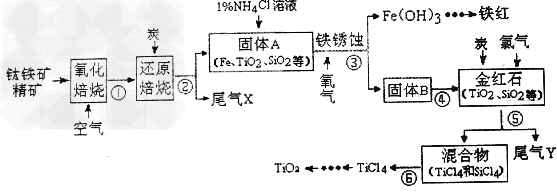
回答下列问题:
(1)选择必要的装置制备并收集干燥、纯净的氧气,按气流方向装置的正确连接顺序为_________________?(填仪器接口的字母编号);检查装置E气密性的操作过程为___________。
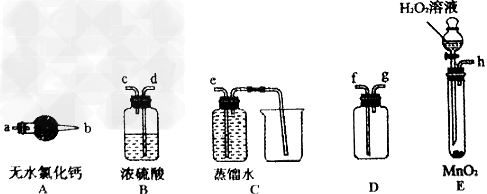
(2)步骤③铁发生电化学腐蚀的过程中,O2除参与电极反应外,还参与另外一个化学反应,该反应的化学方程式为_________________
(3)步级④中固体B经过洗涤得到金红石,验证金红石Cl–己洗净的实验方法是____________
(4)步骤⑤中产生的尾气Y中含有少量Cl2会污染环境,下列可用于吸收Cl2的试剂为_______(填字母序号)?.
a.饱和食盐水?b.浓硫酸?c.浓NaOH溶液?d.石灰乳
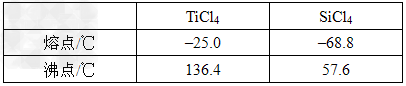
(5)分析下表数据,步骤⑥中分离TiCl4和SiCl4混合物的操作名称为_______,所用到的主要玻璃仪器除酒精灯、温度计外还有________________。
参考答案:(1)hdcfgab(或hdcfg或habfg);用导管连接h,将导管末端浸入盛水的水槽中,关闭分液漏斗的活塞,用手捂热试管,若导管口有气泡冒出,且松手一段时间后,导管中有水回流形成一段稳定的液柱,证明气密性良好
(2)4Fe(OH)2?+?O2?+?2H2O?=?4Fe(OH)3
(3)去最后一次洗涤液,向其滴加硝酸酸化的硝酸银溶液,无白色沉淀形成,证明Cl–已洗净
(4)cd
(5)蒸馏;蒸馏烧瓶、冷凝管、牛角管、锥形瓶
本题解析:
本题难度:一般
4、选择题 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列有关叙述错误的是

[? ]
A.不能用水浴加热
B.长玻璃管作用之一是冷凝回流
C.提纯乙酸丁酯只要用氢氧化钠溶液洗涤后、再用水洗涤即完成
D.加入过量乙酸可以提高1-丁醇的转化率
参考答案:C
本题解析:
本题难度:一般
5、实验题 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】方法:按照下图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。

(1)最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:____________________________ 。
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(2)甲同学查阅资料后,得到Fe(OH)2如下信息:?

阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(3)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(4)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。___________________________________ 。
参考答案:(1)B;Fe+H2SO4=FeSO4+H2↑.FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.H2SO4+2NaOH=Na2SO4+2H2O (中和反应方程式不写不扣分)
(2)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO·Fe2O3·4H2O
(3)打开;发生;Fe(OH)2·nH2O= Fe(OH)2+ nH2O
(4)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)
本题解析:
本题难度:一般