微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ① 0.4mol NaCl的质量为 g,64g氧气的含氧原子数目为 。
②在标准状况下,44.8L NH3的物质的量为 ,与 克H2S的物质的量相等。
③1.5mol SO2与 g SO3含有相同质量的氧元素。等质量的CO与CO2含氧元素质量比为 。
参考答案:(6分)①23.4 g;2.408×1024 或4NA②2mol ;68 g ③ 80g ;11:14
本题解析:①根据m=n·M可知,0.4mol NaCl的质量为m=0.4mol×58.5g/mol=23.4g;同样可知,64g氧气的物质的量是64g÷32g/mol=2mol,属于根据氧气的分子式可知,氧原子的物质的量是2×2mol=4mol,则氧原子数目是4NA。
②根据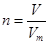 可知,在标准状况下,44.8L NH3的物质的量为44.8L÷22.4L/mol=2mol;2molH2S的质量是2mol×34g/mol=68g。
可知,在标准状况下,44.8L NH3的物质的量为44.8L÷22.4L/mol=2mol;2molH2S的质量是2mol×34g/mol=68g。
③1.5mol SO2中氧原子的物质的量是1.5mol×2=3mol,则根据三氧化硫的分子式可知,三氧化硫的物质的量是3mol÷3=1mol,其质量是80g。根据CO和CO2的分子式可知,等质量的CO与CO2含氧元素质量比为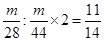 。
。
考点:考查物质的量的有关计算
点评:该题是基础性试题的考查,试题注重基础,侧重能力的培养。该类试题学生需要明确的是在进行物质的量的有关计算时,关键是熟练应用几个关系式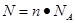 、n=m/M、
、n=m/M、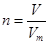 、
、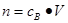 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
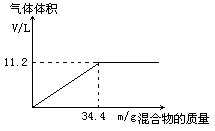
2、计算题 在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
参考答案:解:(1)5mol/L (3分)?(2)15.68 L(3分)(3)16.8L(3分)
本题解析:考查化学计算的过量与不足问题
(1)由图像可知,随着混合物的质量的增加,所得到的氨气的最大体积为11.2L
由反应NH4++OH-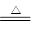 NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
34.4g混合物中所含NH4+的量为0.5mol,设NH4NO3、(NH4)2SO4的物质的量分别为x、y
80x+132y=34.4? x+2y=0.5
解得x=0.1mol? y=0.2mol,即两者的物质的量比为1:2
(2)140mlNaOH提供的OH-的物质的量为0.7mol
固体混合物的质量为51.6g,可计算出NH4NO3、(NH4)2SO4的物质的量分别为0.15mol、0.3mol,提供NH4+的量为0.75mol
由反应NH4++OH-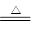 NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
(3)180mlNaOH提供的OH-的物质的量为0.9mol,与固体相比NH4+的量不足,所生成氨气为0.75mol,标准状况下体积为22.4×0.75=16.8L
本题难度:简单
3、选择题 下列叙述中正确的是(?)
A.气体摩尔体积是指单位物质的量的气体所占的体积。
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来。
C.决定气体体积的主要微观因素是气体分子的数目和气体分子的直径大小。
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩尔。
参考答案:A
本题解析:A选项定义正确,B选项摩尔是物质的量的单位,错误。C选项决定气体的体积的因素为分子的数目和分子间的距离,错误。D选项为0.012kg碳-12原子所含有的碳原子数目为1摩尔,错误。
本题难度:一般
4、选择题 NA为阿伏伽德罗常数的值,下列叙述正确的是
A.由D和18O所组成的水11g,所含的中子数为4NA
B.常温常压下,8gO2含有4 NA个电子
C.25℃时,pH=13的1LBa(OH)2溶液中含有OH—的数目为0.2 NA
D.1L1mol/L的NaAlO2水溶液中含有的氧原子数为2NA
参考答案:B
本题解析:A、由D和18O所组成的水11g其物质的量是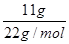 =0.5mol,所含的中子数为(0.5×12)NA=6NA,A不正确;B、常温常压下,8gO2的物质的量是8g÷32g/mol=0.25mol,含有(0.25×16)NA=4NA个电子,B正确;25℃时,pH=13的1LBa(OH)2溶液中氢氧根的浓度是0.1mol/L,则溶液中含有OH—的数目为0.1NA,C不正确;D、溶剂水中含有大量的氧原子,因此1L1mol/L的NaAlO2水溶液中含有的氧原子数大于2NA,D不正确,答案选B。
=0.5mol,所含的中子数为(0.5×12)NA=6NA,A不正确;B、常温常压下,8gO2的物质的量是8g÷32g/mol=0.25mol,含有(0.25×16)NA=4NA个电子,B正确;25℃时,pH=13的1LBa(OH)2溶液中氢氧根的浓度是0.1mol/L,则溶液中含有OH—的数目为0.1NA,C不正确;D、溶剂水中含有大量的氧原子,因此1L1mol/L的NaAlO2水溶液中含有的氧原子数大于2NA,D不正确,答案选B。
本题难度:一般
5、选择题 由氧化铜和氧化铁组成的混合物a g,加入2 mol·L-1的稀硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为
A.1.6a g
B.(a-1.6) g
C.(a-3.2) g
D.无法计算