微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中各微粒的浓度关系不正确的是
[? ]
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-) = c(H+)
B.1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中: c(SO42-)>c(NH4+ )>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3) =c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
参考答案:D
本题解析:
本题难度:一般
2、选择题 将7.84g铁粉完全溶于200 mL 2 mol·L-1硝酸溶液中,放出NO气体,则所得溶液中主要离子的浓度大小顺序正确的是
[?]
A. c(NO3-)>c(Fe2+)>c(Fe3+)>c(H+)
B. c(NO3-)>c(Fe3+)>c(Fe2+)>c(H+)
C. c(Fe2+)>c(Fe3+)>c(NO3-)>c(H+)
D.c(Fe2+)>c(NO3-)>c(Fe3+)>c(H+)
参考答案:A
本题解析:
本题难度:一般
3、填空题 在自然界中,碳及其化合物之间进行着永不停息的转化,这些转化是非常重要的。
(1)在空气中久置的石灰水往往会失效,不能再用来检验二氧化碳气体。石灰水在空气中失效的原因可以用化学方程式表示为___________;石灰水失效后的试剂瓶内壁附着有白色物质,要清除这些物质可用的试剂是____________________。
(2)曰前大多数机动车都是采用化石燃料(燃油或燃气),使用化石燃料的机动车尾气中含有CO、NO等污染物。汽车排气管道中安装催化转化器,可使CO、NO等有害气体转化为无毒物质,从而减少尾气中有害物质的排放。已知反应:
①N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
则反应④2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
N2(g)+2CO2(g)的△H=__________kJ/mol。一定条件下,在一容积为1L的密闭恒容容器中通入2molNO和2molCO,在一定条件下发生上述反应④,下列不能说明反应达到平衡状态的是____________。
a.NO和CO的体积比保持不变
b.混合气体的平均摩尔质量保持不变
c.体系内压强保持不变
d.每生成1molN2的同时消耗2molCO2
测得上述反应达到平衡时,CO2的物质的量是CO的2倍,则该温度下的化学平衡常数K=________。
(3)大气中过多的二氧化碳会导致地球温室效应,给地球带来灾难,二氧化碳可以溶解在碱液中。现将1.12L(标准状况)CO2通入体积为100mL浓度为1mol/L的NaOH溶液中,该反应的离子方程式为_________________,所得溶液中离子浓度由大到小的顺序为________________________________。
参考答案:(1)Ca(OH)2+CO2=CaCO3↓+H2O;盐酸(“稀盐酸”、“稀硝酸”等合理答案均可)
(2)-746.5;a;6
(3)CO2+2OH-=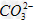 +H2O;c(Na+)>
+H2O;c(Na+)>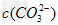 >c(OH-)>
>c(OH-)> >c(H+)
>c(H+)
本题解析:
本题难度:一般
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是?
[? ]
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)?=?c(HRO3-)?+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中c(NH4+):③<②<①?
D.相同条件下,pH=5的①NH4C1溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
参考答案:A
本题解析:
本题难度:一般
5、简答题 (1)有下列物质①Cu②液态SO2③CH3COOH④NaHCO3⑤H2O⑥熔融NaCl⑦BaSO4属于弱电解质的是______(填序号)
(2)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:______.NaHCO3水解的离子方程式.
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液
的pH
a
0.1
0.1
pH=9
b
c
0.2
pH=7
|
请回答:
①从a组情况分析,HA是强酸还是弱酸______.
②b组情况表明,c______0.2(选填“大于”、“小于”或“等于”)混合溶液中离子浓度
c(A-)______c(Na+).(选填“大于”、“小于”或“等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)=______mol?L-1.
参考答案:(1)弱电解质在水溶液中部分电离,存在电离平衡,满足该条件为:③CH3COOH、⑤H2O,故答案为:③⑤;
(2)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,说明了HCO3-的水解程度大于其电离程度,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-);碳酸氢钠溶液中HCO3-部分水解生成碳酸和氢氧根离子,其水解方程式为:HCO3-+H2O=H2CO3+OH-,
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-);HCO3-+H2O=H2CO3+OH-;
(3)①根据a可知:等体积等浓度混合,恰好生成正盐,溶液的pH=9,说明生成强碱弱酸盐,所以HA为弱酸,故答案为:HA是弱酸;
②若该酸为强酸,等体积等浓度混合时pH=7,而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度应该大于0.2mol/L;
溶液的pH=7,溶液中c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)=c(Na+),
故答案为:大于;等于;
③由a组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,所以水电离的溶液中的c(OH-)=10-5mol/L,
故答案为:10-5.
本题解析:
本题难度:简单