微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,可逆反应达到化学平衡时,下列说法中正确的是
A.单位时间内反应物减少的分子数等于生成物增加的分子数
B.反应物的浓度一定等于生成物的浓度
C.混合物中各组分的质量分数是一定的
D.反应物和生成物的浓度比一定等于化学方程式的系数比
参考答案:C
本题解析:略
本题难度:简单
2、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为? ?。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H?0(填“>”或“<”),上述反应体系中循环使用的物质是?。
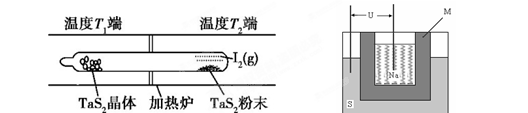
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
参考答案:(1)80%(2分)(2)>(1分); I2(2分)(3)xS+2e-=Sx2-(2分);离子导电(2分)
(4)S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分)
c(HS-)+2c(S2-)+c(OH-) (2分)
本题解析:(1)? TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始量(mol)? 1? 0? 0
转化量(mol)? 2x? x? x
平衡量(mol)? 1-2x? x? x
由于反应前后体积不变,因此可以用物质的量代替物质的量浓度表示其平衡常数,即
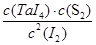 =4=
=4=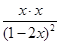
解得x=0.4
所以I2(g)的平衡转化率为 ×100%=80%
×100%=80%
(2)加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,这说明低温有利于TaS2晶体的生成,因此逆反应是放热反应,则正方应是吸热反应,即△H>0;先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),而最后又产生单质碘,因此单质碘是可以循环的物质。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式2Na + xS=Na2Sx可知,钠是还原剂,做负极,S单质是氧化剂,在正极得到电子,因此正极反应式为xS+2e-=Sx2-。在熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,因此另外一种作用是离子导电。
(4)硫化钠是强碱弱酸盐,S2-水解溶液显碱性,因此Na2S溶液水解的离子方程式为S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
本题难度:一般
3、选择题 在2L容积不变的容器中,发生N2+3H2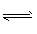 2NH3的反应。现通入4 molH2和4molN2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 molH2和4molN2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
[? ]
A.1.6 mol
B.2.8 mol
C.3.2 mol
D.3.6 mol
参考答案:C
本题解析:
本题难度:简单
4、选择题 在恒温、恒容的密闭容器中进行反应A(g) B(g)+C(g)。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需反应时间为?
B(g)+C(g)。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需反应时间为?
[ ]
A.10s
B.大于10s
C.小于10s
D.无法判断
参考答案:B
本题解析:
本题难度:一般
5、选择题 一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:
2A(g)+3B(g) 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是?
4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是?
A、前10min反应的平均速率V(C)=0.10mol/L·min
B、10min后向容器中加入A,重新平衡时 A的转化率一定大于50%
A的转化率一定大于50%
C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L
D、反应达平衡时B的平衡浓度是1.5mol/L
参考答案:D
本题解析:达平衡时D的浓度为0.5mol/L,故用D表示的反应速率是V(D)=0.050mol/L·min,故V(C)=0.20mol/L·min,故A错;此反应为等体反应,加压平衡不移动,故10min后向容器中加入A,重新平衡时 A的转化率一定等于50%,恒温下将反应容器体积缩小一半,则D的平衡浓度等于1.0mol/L,所以B、C错误;D对。
A的转化率一定等于50%,恒温下将反应容器体积缩小一半,则D的平衡浓度等于1.0mol/L,所以B、C错误;D对。
本题难度:一般