微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子可能大量共存的是
[? ]
A.PH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.含有大量OH-的无色溶液中:Na+、Cu2+、[Al(OH)4]-、SiO32-
D.常温下水电离出的离子浓度符合c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列各组中的离子,能在溶液中大量共存的是
A.Ag+、Al3+、NO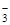 、H+
、H+
B.H+ 、Na+、CO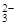 、Cl-
、Cl-
C.K+、H+、SO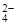 、OH-
、OH-
D.Ba2+、Na+、Cl-、SO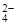
参考答案:A
本题解析:离子键如果发生化学反应,则不能大量共存,反之是可以的,A中可以大量共存。B中H+和CO32-不能大量共存。Cz和H+和OH-不能大量共存。D中Ba2+和SO42-不能大量共存,答案选A。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可来源:91考试网 91ExaM.org排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中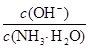 增大
增大
参考答案:C
本题解析:由电荷守恒可知c(NH4+)+c(H+)=2c(SO42-)+c(OH-),当pH=7时,c(NH4+)=2c(SO42-),故A项错;醋酸是弱酸,浓度越大,电离程度越小,当两溶液pH相差1时,c1≠10c2,B项错;pH=11的NaOH与pH=3的醋酸等体积混合后溶液显酸性,滴入石蕊试液呈红色,C项对;氨水存在电离平衡:NH3·H2O?NH4++OH-,加(NH4)2SO4固体,平衡左移,导致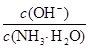 减小,D项错。
减小,D项错。
本题难度:一般
4、选择题 下列各组离子在给定条件下能大量共存的是 ( )
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO42-存在溶液中:Na+、Mg2+、Ba2+、I-
C.在酸性溶液中:NH4+、Ba2+、Fe2+、NO3-
D.在c(H+)=1.0×10-13mol/L的溶液中:Na+、S2-、AlO2-、SO32-