微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于只含非金属元素的化合物的说法中,正确的是
[? ]
A. 有可能是离子化合物
B. 一定是共价化合物
C. 其晶体不可能是原子晶体
D. 其晶体不可能是离子晶体
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列B组中命题正确且能用A组命题加以正确解释的是(?)
A组
| B组
|
Ⅰ.H—I键键能大于H—Cl键键能
Ⅱ.H—I键键能小于H—Cl键键能
Ⅲ.HI分子间作用力大于HCl分子间作用力
Ⅳ.HI分子间作用力小于HCl分子间作用力
| ①HI比HCl稳定
②HI比HCl不稳定
③HI沸点比HCl高
④HI沸点比HCl低
|
A.Ⅰ、①? B.Ⅳ、②? C.Ⅲ、③? D.Ⅱ、④
参考答案:C
本题解析:H—I键键能小于于H—Cl键键能,氯化氢比碘化氢稳定性强,A、B不正确;碘化氢的相对分子质量大于氯化氢的相对分子质量,所以碘化氢的分子间作用力大于氯化氢的分子间作用力,因此沸点是碘化氢的大于氯化氢的,则选项C正确,D不正确,答案选C。
点评:该题主要是考查学生对氢化物稳定性与化学键关系,以及氢化物沸点高低与分子间作用力关系的了解掌握情况,意在培养学生分析、归纳、总结问题的能力。有利于培养学生的逻辑思维能力和抽象思维能力。
本题难度:一般
3、简答题 下列化学用语书写正确的是( )
A.NH3分子的结构式:
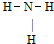
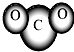
B.CO2分子模型的示意图:
C.乙烯分子的结构简式:CH2CH2
D.Na2O的电子式:
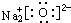
参考答案:A、NH3分子中氮原子最外层5各电子,有三个单电子,与氢原子结合时形成三个共价键,故A正确;
B、二氧化碳分子结构是直线型,选项中的模型中原子的相对位置不对,故B错误;
C、乙烯分子的结构简式中的双键不能省略,故C错误;
D、氧化钠是由钠离子和氧离子构成,电子式的书写两个钠离子不能合并,选项中的电子式不能正确表述得失电子关系,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.离子化合物中一定含有金属元素
B.含有共价键的化合物一定是共价化合物
C.离子化合物一定存在离子键
D.CO2由固态变成气态时一定破坏共价键
参考答案:C
本题解析:
本题难度:一般
5、填空题 从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
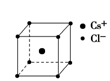
(1)下列说法正确的是?(填字母).
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As