微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是

A.图中A点溶液的pH=1
B.生成沉淀的最大质量为2.33g
C.原混合溶液中盐酸物质的量浓度为0.1mol/L
D.当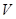 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO
[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO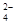 ═BaSO4↓
═BaSO4↓
参考答案:A
本题解析:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+2H2O,发生的离子方程式是2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,D错;20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4?+? Ba(OH)2?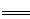 ?BaSO4↓? +? H2O
?BaSO4↓? +? H2O
1?1? 233g
x?0.02L×0.05mol·L-1? y
故x=0.02L×0.05mol·L-1=0.001mol,y=0.233g,
硫酸的物质的量浓度为 ?=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
?=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol·L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度= ?=0.2mol·L-1,C错;
?=0.2mol·L-1,C错;
由图可知,A点硫酸完全反应,氢离子的浓度为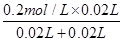 =0.1mol·L-1,则pH=-lg0.1=1,A对;
=0.1mol·L-1,则pH=-lg0.1=1,A对;
综上所述,所以选A。
本题难度:简单
2、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L的H2O所含的分子数为NA
B.1mol T2O分子所含的中子数为10NA
C.常温常压下,20g D2O分子中所含的质子数为10NA
D.1mol H3O+所含的电子数为11NA
参考答案:C
本题解析:A、标准状况下,水为液态;B、T2O分子中含有2×2+8=12个中子;C、20g D2O的物质的量为1mol,D2O中的质子数为10个,故20g D2O分子中所含的质子数为10NA,正确;D、H3O+中含有10个电子。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,1L液态水中含有的H+ 数目10-7NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于0.001NA
D.1mol碳烯(:CH2)中含有电子数为8NA
参考答案:D
本题解析:A错,标准状况下水的离子积常熟小于1×10-14;B错,由于不知道气体的的温度和压强,无法计算气体的物质的量,也无法计算专一电子数;C错,不知道溶液的体积和醋酸浓度,无法计算醋酸分子数。D正确,:CH2粒子中含有8个电子。
本题难度:一般
4、选择题 相同物质的量浓度的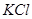 、
、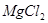 、
、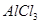 三种溶液,分别与体积相同、物质的量浓度相同的
三种溶液,分别与体积相同、物质的量浓度相同的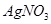 溶液恰好完全反应,消耗的这三种溶液的体积比是
溶液恰好完全反应,消耗的这三种溶液的体积比是
A.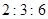
B.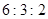
C.
D.
参考答案:B
本题解析:设硝酸银是1mol,则根据反应式Ag++Cl-=AgCl↓可知,消耗氯化钾、氯化镁和氯化铝的物质的量分别都是1mol。又因为三种溶液的浓度相同,即cV1=2cV2=3cV3,所以消耗的这三种溶液的体积比是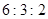 ,答案选B。
,答案选B。
本题难度:一般
5、选择题 10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
A.0.02 mol/L?B.0.05 mol/L? C.0.25 mol/L?D.0.5 mol/L
参考答案:D
本题解析:10 g 10%的氢氧化钠溶液中溶质的质量=10g×10%=1g,物质的量=1g÷40g/mol=0.025mol/L。溶液的体积是0.05L,所以稀释后溶液的物质的量浓度=0.025mol÷0.05L=0.5mol/L,答案选D。
本题难度:一般