微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 阅读下表中短周期主族元素的相关信息。
元素代号
| 相关信息
|
A
| A的单质能与冷水剧烈反应,得到强碱性溶液
|
B
| B的原子最外层电子数是其内层电子数的三倍
|
C
| 在第3周期元素中,C的简单离子半径最小
|
D
| A、B、D组成的36电子的化合物X是家用消毒剂的主要成分
|
E
| 所有有机物中都要有E元素
|
?
请回答:
(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提
供能源。?写出该原电池正极的电极反应式?。
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
?
其中,阴极产物是?
(3)常温下,0.1 mol·L-1X溶液的pH_____7(填“>”、“=”或“<”),原因是?(用离子方程式说明)。向1.5 L O.1 mol·L-1 A的最高价氧化物对应水化物的水溶液中通人标况下2.24L EB2,充分反应后,溶液中各离子浓度由大到小的顺序是?。
(4)已知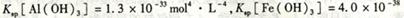 mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
??(填字母代号)。
参考答案:
本题解析:略
本题难度:简单
2、实验题 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2中的几种均匀混合而成,取样品进行如下实验(部分产物略去):

(1)Z的分子式是?。
(2)在实验②中观察到的现象是“沉淀部分溶解”。为进一步确定X的组成,向实验②后的溶液中滴加过量的氨水,有沉淀生成,写出生成沉淀的离子反应方程式为
?,则沉淀X含有的物质的化学式为? 、 、 。
(3)取滤液Y,测得其pH > 7,向其中滴入硫酸钠溶液,未观察到任何现象,则滤液Y中一定含有的含氧酸根离子是(用离子符号表示) ?、?,由此推测“将过量的气体Z通入滤液Y中”的实验现象是?。
参考答案:(1) CO2?………………………… …………………………1 分
(2) Al3+ + 3NH3?H2O? ="=?" Al(OH)3↓ + 3NH4+?……………………1 分
CaCO3? BaSO4?Al(OH)3 …… ……………2分(能答对2个,给2分)
(3) AlO2—(或[Al(OH)4] —、?NO3—?………… ……………………………………… …………… …1 分
有白色沉淀产生……………………………………… ………… ……1 分
本题解析:略
本题难度:一般
3、填空题 下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中常见的金属单质,J是黄绿色气态单质,M与氨水反应生成的O是白色沉淀。在B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)H元素在周期表中的位置?。
(2)反应③的离子方程式?;
反应④的化学方程式 ? 。
(3)实验室用固体L配制溶液的方法是:
?。
(4)由L的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是?。若要提纯该胶体,采用的方法叫?。
参考答案:(1)第四周期、第Ⅷ族(2分)
(2)SO2+Cl2+2H2O=4H++SO +2Cl—(2分)
+2Cl—(2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)取FeCl3固体溶于浓盐酸,再加水稀释到所需的浓度(2分)
(4)1 nm~100 nm(1分)?渗析(1分)
本题解析:略
本题难度:一般
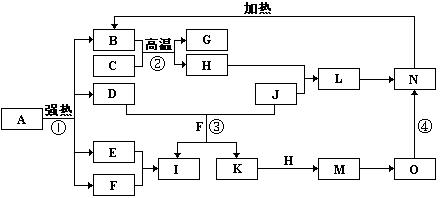
4、填空题 (13分)中学常见物质A~L的转化关系如下图:(无关产物已略去)
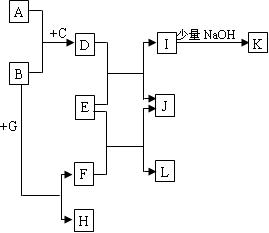
①A、B、H均为单质,A、B有金属光泽,A可以在常温下溶于L的浓溶液,H为黄色固体,向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气。
②D、E、F、I、L都是无色溶液,G是无色气体。
③K是一种白色沉淀,J是一种黄色沉淀,将G通入E后可以产生一种黑色沉淀和L。
(1)写出下列物质的名称:
A??B??H?
(2)A和F也可以反应生成D,写出此化学反应方程式?。
(3)写出试题中出现的几种沉淀的化学式:白色沉淀?;黄色沉淀?;黑色沉淀?。
(4)写出电解E溶液的电极反应式?阳极:?;阴极:?。
参考答案:(1)锌 碘 硫? (共3分)
(2)Zn+2HI=ZnI2+H2↑ (3分)
(3)Zn(OH)2?AgI? Ag2S?(共3分)
(4)4OH--4e-=2H2O+O2↑ Ag++e-="4Ag?" (共4分)
本题解析:根据“向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气”可知Zn 与I2在H2O为催化剂下反应生成ZnI2(D),又因H为黄色固体,可知H为S,再结合题设条件和框图转化可推知G为H2S,F为HI溶液,E为AgNO3溶液,I为Zn(NO3)2溶液、J为AgI沉淀、L为HNO3溶液、K为Zn(OH)2。电解AgNO3溶液时,Ag+在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH―在阳极失去电子产生O2:4OH--4e-=2H2O+O2↑。
本题难度:一般
5、填空题 X、Y是短周期同主族元素,Z是过渡元素,化合物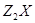 、
、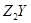 可发生如下转化。
可发生如下转化。

(1)X的元素符号为_________,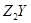 的化学式为_________。
的化学式为_________。
(2)蓝色溶液中含有的阴离子是_______________。
(3)过程②中发生反应的离子方程式为_______________。
参考答案:(1)S?;Cu2S;?(2)NO3—、SO42-、OH-(3)H++OH-=H2O、Cu2++2OH-=Cu(OH)2↓
本题解析:X、Y是短周期同主族元素,Z是过渡元素,反应①生成蓝色溶液,则含Cu2+,由蓝色浊液与葡萄糖在加热的条件下反应生成Z2Y,则蓝色浊液为新制氢氧化铜悬浊液, Z2Y为Cu2O,,推出Y为O,X为S,Z为Cu, (1)由上述分析可知,X为S,Z2Y为Cu2O;(2)反应①为硫化亚铜与硝酸的氧化还原反应,反应生成硫酸铜、硝酸铜、NO、水,同时还存在剩余的硝酸,则溶液中的阴离子有NO3-、SO42-、OH-;(3)过程②中发生酸碱中和及铜离子与碱的反应,离子反应分别为H++OH-=H2O、Cu2++2OH-=Cu(OH)2↓。
本题难度:一般