微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
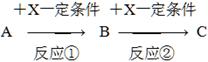
试回答:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为________;C溶液在储存时应加入少量X,理由是(用必要的文字和离子方程式表示)___________________。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为________或________。
参考答案:(1)de?(2)FeCl3 Fe+2Fe3+===3Fe2+,防止Fe2+被氧化成Fe3+
(3)Al(OH)3 HCl NaOH? AlO2—+H++H2O===Al(OH)3↓?Al3++3OH-===Al(OH)3↓
本题解析:此转化关系与我们熟悉的连续氧化非常相似。
(1)当X是强氧化性单质(如:O2)时,S、N2、Na均可被连续氧化,而Mg、Al只能被氧化一次。因此A不可能是Mg、Al。
(2)由于C溶液中滴加AgNO3溶液生成不溶于稀硝酸的白色沉淀,所以C中含有Cl-,X应为变价金属,我们常见的有铁、铜等,经验证,X为Fe,A为Cl2。
Cl2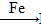 FeCl3
FeCl3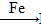 FeCl2,B为FeCl3,C为FeCl2,由于Fe2+易被氧化,储存FeCl2溶液时常加入少量铁粉。
FeCl2,B为FeCl3,C为FeCl2,由于Fe2+易被氧化,储存FeCl2溶液时常加入少量铁粉。
(3)A、B、C均含同一种金属元素,结合题意可推出,应是含铝化合物与酸或碱的反应。如:
NaAlO2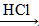 Al(OH)3
Al(OH)3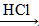 AlCl3或AlCl3
AlCl3或AlCl3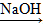 Al(OH)3
Al(OH)3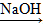 NaAlO2
NaAlO2
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、简答题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.请回答下列问题:
(1)E的电子式为______.
(2)反应③的离子方程式为______.
(3)F与G的溶液反应的化学方程式为______.
(4)检验溶液L中金属阳离子的方法是______.
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为______(此分子式中元素符号书写次序按从左往右元素原子序数“大小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为______.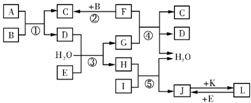
参考答案:C、D均能使澄清的石灰水变混浊,能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C、D属于二氧化碳和二氧化硫;E为单质,D、E均能使品红溶液褪色,能使品红溶液褪色的有氯气和二氧化硫,所以D是二氧化硫,C是二氧化碳,E是氯气;I是一种红棕色固体氧化物,I是氧化铁;B、F为单质,其中F为黑色固体,F和B反应生成二氧化碳,所以F是碳,B是氧气;A和氧气反应生成二氧化碳和二氧化硫,所以A是;氯气和水、二氧化硫反应生成硫酸和盐酸,碳和硫酸反应,所以G是硫酸,H是盐酸;盐酸和氧化铁反应生成氯化铁和水,所以J是氯化铁;K为单质,J和K反应生成L,L和氯气反应生成氯化铁,所以L是氯化亚铁,K是铁.
(1)E是氯气,E的电子式为:
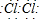
.
故答案为:
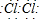
.
(2)氯气和二氧化硫、水反应生成硫酸和盐酸,离子反应方程式为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+.
故答案为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+
(3)碳和硫酸在加热条件下反应生成二氧化硫和二氧化碳、水,
反应方程式为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
(4)二价铁离子的检验方法是:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色就证明有二价铁离子存在.
故答案为:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色.
(5)气体A的密度为相同状况下氢气密度的30倍,所以A的相对分子量是氢气的30倍,即A的相对分子量为60,且A中含3种组成元素,通过以上分析A中一定含有硫和碳元素,且A和氧气反应后生成二氧化硫和二氧化碳,所以A含有氧元素,分子式为SCO;A分子中各原子均达8电子稳定结构,则其结构式为S=C=O.
故答案为:SCO;S=C=O.
本题解析:
本题难度:一般
3、简答题 已知有以下物质相互转化:
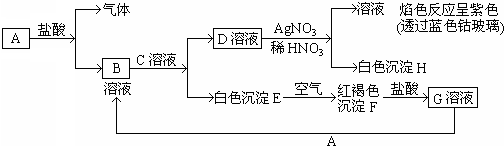
试回答:
(1)写出B的化学式______D的化学式______.
(2)写出由E转变成F的化学方程式______.
(3)写出用KSCN鉴别G溶液的离子方程式______;向G溶液加入A的有关离子反应方程式______.
参考答案:D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾.
(1)通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,故答案为:FeCl2;KCl;
(2)E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气、水反应生成氢氧化铁,反应方程式为:4Fe?(OH)2+O2+2H2O═4Fe?(OH)3,
故答案为:4Fe?(OH)2+O2+2H2O═4Fe?(OH)3;
(3)铁离子和硫氰根离子反应生成硫氰化铁,离子反应方程式为:Fe3++3SCN-═Fe?(SCN)3 ,铁离子和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe3++3SCN-═Fe(SCN)3;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:一般
4、填空题 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,E为液体,D为黑色固体,则B的化学式为______,A与E在一定条件下反应生成D的化学方程式为______.
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素.则构成非金属单质A的元素原子结构示意图为______,A与E在一定条件下反应生成D的离子方程式为______.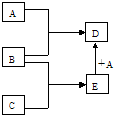
参考答案:(1)B、C为非金属单质,且常温下B、C均为无色气体,E为液体,应为H2O,金属A与水反应生成黑色固体,应为Fe与水的反应,生成的D为Fe3O4,则A为Fe,B为O2,C为H2,A与E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)?高温?.?Fe3O4+4H2,
故答案为:O2;3Fe+4H2O(g)?高温?.?Fe3O4+4H2;
(2)若A为非金属单质,且常温下为黄绿色气体,应为Cl2,构成非金属单质A的元素原子结构示意图为

,
B为金属单质,由转化关系可知应为变价金属,应为Fe,C为酸,且C的组成中含有与A相同的元素,C应为盐酸,
则E为FeCl2,D为FeCl3,A与E在一定条件下反应生成D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
故答案为:

;2Fe2++Cl2=2Fe3++2Cl-.
本题解析:
本题难度:简单
5、填空题 (12分)已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液体。各物质间的转化关系如下图所示(某些条件已略去)。
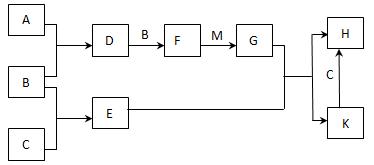
请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 ? B. 还原性 ? C. 漂白性
(4)C与M在一定条件下反应的化学方程式为?。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为 ? ?。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因:?。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品?吨。
参考答案:(12分)
(1)Fe2(SO4)3
(2)?(2分)
高温
本题解析:略
本题难度:一般