微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学学习小组对铝与酸和碱的反应进行探究,过程如下。
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的?(填写相应的字母);
a. 盐酸的物质的量浓度大于硫酸的物质的量浓度
b. Cl-能促进此反应的进行
c. SO42-能抑制此反应的进行
d. 硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分。
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸。
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的?(填写相应的试剂,下同),再向其中的一支试管中加入适量的?固体并振荡使固体溶解,观察实验现象。
实验探究:略。
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者?后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为??;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的。
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物。
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
① 向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解。实验时发现固体完全溶解,证明猜想?一定不正确(填“1”、“2”、“3”、“4”)。
② 向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解。实验时发现固体完全溶解,证明猜想?一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想?(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:?。
参考答案:实验I:(1)bc;(2分)(2)3mol/LH2SO4、氯化钠固体(或6mol/LHCl、硫酸钠固体)(2分)
实验II:大于(2分)(1)2Al+Fe2O3 2Fe + Al2O3;(3分)
2Fe + Al2O3;(3分)
(2)①2(1分);②1(1分);
(3)3(1分),2Al+2OH-+2H2O=2AlO2-+3H2↑;(3分);
本题解析:实验I:(1)两实验现象的差异原因应从反应物组成的不同点去寻找,此题中其他条件均相同,不同的是盐酸中含有Cl-而硫酸中含有SO42-,所以从这个方面思考即可得答案;
(2)根据控制变量法和对比实验法,在控制其他条件相同时,只让两实验中有一个变量不同。如:都用稀硫酸,但其中一份加入Cl-而另一份不加Cl-,即可得出结论(类似方法亦可)。
实验II:由化学方程式可知,等物质的量的HCl与NaOH相比,NaOH消耗的铝更多,所以留下的铝就少,故“前者大于后者”;
(1)根据信息和有关物质的性质,可以看出黑色固体可能是铝、铁、硅三种单质中的一种或几种,从而提出猜想。猜想1中铁的生成是由于电解法时生成的铝能与氧化铁发生铝热反应,由此可写出相应的化学反应方程式;猜想2的化学反应方程式根据题意就可直接写出;
(2)①在盐酸中固体完全溶解,证明一定不含硅,所以猜想2一定不正确;
②在氢氧化钠溶液中固体完全溶解,证明一定不含铁,所以猜想1一定不正确;
(3)综合(1)(2)中相应的结论,可知此固体只含有铝,故猜想3正确,猜想4不正确,固体是铝,铝与氢氧化钠溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
本题难度:一般
2、选择题 下列实验过程中,始终无明显现象的是( )
A.Cl2通入AgNO3溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入Ba(NO3)2溶液中
参考答案:A.氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银白色沉淀,故A不选;
B.因碳酸酸性比盐酸弱,CO2与CaCl2溶液不反应,无任何现象,故B选;
C.氨气溶液呈碱性,生成白色氢氧化铝沉淀,故C不选;
D.二氧化硫溶液呈酸性,酸性条件下,可被硝酸根离子氧化生成硫酸根离子,可生成硫酸钡沉淀,故D不选.
故选B.
本题解析:
本题难度:简单
3、选择题 1820年德贝莱纳用MnO2作催化剂使KClO3分解产生O2,发现制得的O2有异常气味,使该气体通过淀粉碘化钾溶液,溶液变蓝色,则氧气中可能混有(? )
①Cl2?②Br2?③NO2?④O3?⑤CO2
A.①②
B.②③
C.①④
D.全部
参考答案:C
本题解析:由于制得的气体能使淀粉碘化钾溶液变蓝,说明具有较强氧化性的气体生成,且由MnO2、KClO3的组成根据元素守恒排除Br2、NO2、CO2,可能为Cl2、O3。
本题难度:简单
4、填空题 (1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl="2KCl" +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况?。
②漂白粉的有效成分是(填化学式)?。
参考答案:(1)2:3; 1:1; 2:3
(2)还原性 酸性 14.2克; 2.408×1023
(3)
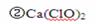
本题解析:略
本题难度:简单
5、选择题 原子X转移一个电子给原子Y,形成化合物HY,下列说法正确的是(?)
A.X被氧化了
B.X是氧化剂
C.X发生还原反应
D.Y在反应中表现了氧化性
参考答案:A
本题解析:X失电子,被氧化,发生氧化反应,是还原剂,表现还原性。A正确,B、C错。Y在反应中作氧化剂,表现氧化性,D错。
本题难度:简单