微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)舍勒发现氯气的的方法至今还是实验室制取氯气的主要方法之一.
(1)请写出实验室制氯气的反应化学方程?,
(2)反应方程式中氧化剂和还原剂物质的量之比为?;其中Cl2是??产物(填氧化或还原);
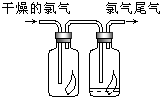
(3)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ?,从而得出的结论是?.
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式?。
参考答案:(12分,每空2分)(1)MnO2 + 4HCl(浓)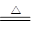 MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
MnCl2 +Cl2↑+ 2H2O;(2)1:2;氧化
(3)干燥有色布条不褪色,湿润的有色布条褪条,氯气不具有漂白性,次氯酸具有漂白性。
(4)Cl2 + 2OH-=Cl- + ClO- + H2O
本题解析:(1)实验室用二氧化锰和浓盐酸反应制取氯气,所以实验室制氯气的反应化学方程是MnO2 + 4HCl(浓)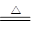 MnCl2 +Cl2↑+ 2H2O。
MnCl2 +Cl2↑+ 2H2O。
(2)根据方程式可知,Mn元素的化合价从+4价降低到+2价,得到2个电子,而氯元素的化合价从-1价升高到0价,失去1个电子,所以氯气是氧化产物,根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是1:2。
(3)干燥的氯气是没有漂白性的,真正起漂白作用的是次氯酸,所以实验中的现象是干燥有色布条不褪色,湿润的有色布条褪条。因此结论就是氯气不具有漂白性,次氯酸具有漂白性。
(4)氯气有毒需要尾气处理,反应的离子方程式是Cl2 + 2OH-=Cl- + ClO- + H2O。
点评:该题是基础性试题的考查,难度不大。该题的关键是学生要熟练记住氯气的制备原理、氯气的性质,特别是化学性质。另外本题也有利于培养学生的实验安全意识,提高学生的规范操作能力。
本题难度:一般
2、填空题 (10分)(I) 海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:
①在滤液中,滴加几滴硫酸和适量的双氧水?②将海带烧成灰,向灰中加水,加热搅拌?
③加CC14振荡、静置?④过滤?⑤分液。?
(1)合理的操作顺序为?。
(2)步骤③中要用到的玻璃仪器为?,该步分离I2的操作叫?。
(II)向某含有Fe2+、I—、Br—的溶液中缓缓通入适量氯气,溶液中各种离子的物质的量变化如图所示。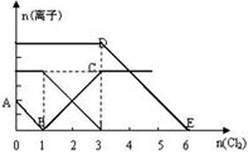
(3)AB段表示??离子的减少。
(4)n(Cl2)=2mol时,溶液中反应的离子方程式为?。
参考答案:(I)(1) ②④①③⑤;(2) 分液漏斗;萃取;(II) (3) I-;(4)? Cl2+2Fe2+=2Fe3++2Cl-?。
本题解析:(I)(1) 证明海带中含有碘元素的实验操作方法是②将海带烧成灰,向灰中加水,加热搅拌;④过滤;①在滤液中,滴加几滴硫酸和适量的双氧水;③加CC14振荡、静置;⑤分液。(2)在步骤③中要用到的玻璃仪器为分液漏斗;该步分离I2的操作叫萃取;(II)由于还原性I—> Fe2+>Br—,所以首先发生反应的是I—。反应的离子方程式是?Cl2+2I-===2Cl-+I2;n(I-)=2mol.再通入Cl2,会继续发生反应:Cl2+2Fe2+=2Fe3++2Cl-。当通入Cl2至3mol时,该反应完全,再发生反应:?Cl2+2Br-===2Cl-+Br2.
本题难度:一般
3、选择题 下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.使红色布条褪色(HCl)
B.将NaHCO3固体加入新制氯水,有无色气泡(H+)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
参考答案:A、氯水中的次氯酸能使红色布条褪色,与HCl无关,故A选;
B、因氯水中有盐酸和次氯酸,均可电离生成H+,H+能与NaHCO3固体反应生成二氧化碳气体,则会有无色气泡出现,故B不选;
C、因氯水中的氯气能将亚铁离子氧化为铁离子,再滴加KSCN溶液,发现呈血红色,故C不选;
D、因氯水中的盐酸电离生成Cl-,氯离子能与硝酸银发生复分解反应生成氯化银白色沉淀,故D不选;
故选A.
本题解析:
本题难度:一般
4、选择题 被誉为"太空金属"的钛,在室温下,不跟水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是
A.氢氟酸的酸性比其他酸强
B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强
D.钛离子易与氟离子形成可溶性难电离物质
参考答案:D
本题解析:
正确答案:D
氟原子半径小,电负性大,与其它原子间作用力大,决定了氟有许多特殊的性质。D符合。
A.不正确,氢氟酸是弱酸,酸性比其他酸弱? B.不正确,氢氟酸是非氧化性酸,氧化性不比其他酸强; C.不正确,氢氟酸中的-1价的氟,很难失电子,还原性比极弱。
本题难度:简单
5、选择题 将X气体通入Y溶液中,实验结果与预测的现象一致的组合是
?
| X气体
| Y溶液
| 预测的现象
| 
|
①
| CO2
| 饱和Na2CO3溶液
| 白色沉淀析出
|
②
| SO2
| Ba(NO3)2溶液
| 白色沉淀析出
|
③
| Cl2
| AgNO3溶液
| 白色沉淀析出
|
④
| NH3
| AlCl3溶液
| 白色沉淀析出
|
?
A.只有①②③?B.只有①②④? C.只有①③④? D.①②③④
参考答案:D
本题解析:
试题分析:①将CO2通入到饱和Na2CO3溶液中发生化学反应:CO2+H2O+ Na2CO3=2NaHCO3,NaHCO3比Na2CO3的溶解度小,因此有沉淀析出,正确;②SO2和水反应可以生成H2SO3,溶液显酸性,Ba(NO3)2可以电离出NO3-,在酸性溶液中具有强氧化性,因此SO2与Ba(NO3)2不可能发生简单的复分解反应,SO2通入到Ba(NO3)2溶液中可发生氧化还原反应:3SO2+2H2O+2NO3-=3SO42- 十4 H++2NO↑,SO42-+Ba2+=BaSO4↓,错误;③Cl2+H2O=HCl+HClO,HCl+AgNO3=AgCl↓+HNO3,正确;④NH3 +H2O= NH3·H2O,3NH3·H2O+AlCl3=Al(OH)3↓+3NH4Cl,正确。故答案为D。3-在酸性条件下具有强氧化性以及H2SO3具有还原性的性质。)。
本题难度:一般