微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中,导电性能最差的是( )
A.熔融氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
参考答案:D
本题解析:
本题难度:一般
2、简答题 下列化学用语书写正确的是( )
A.NH3分子的结构式:
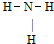
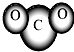
B.CO2分子模型的示意图:
C.乙烯分子的结构简式:CH2CH2
D.Na2O的电子式:
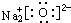
参考答案:A、NH3分子中氮原子最外层5各电子,有三个单电子,与氢原子结合时形成三个共价键,故A正确;
B、二氧化碳分子结构是直线型,选项中的模型中原子的相对位置不对,故B错误;
C、乙烯分子的结构简式中的双键不能省略,故C错误;
D、氧化钠是由钠离子和氧离子构成,电子式的书写两个钠离子不能合并,选项中的电子式不能正确表述得失电子关系,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 下列排列顺序正确的是( )
A.固体的热稳定性:Na2CO3>CaCO3>NaHCO3
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.电离出氢离子的能力:CH3COOH>C2H5OH>H2O
D.氢化物的沸点:H2Se>H2S>H2O
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (8分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子对数与未成对电子数之比为3:1。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
(1)D元素在元素周期表中的位置为第 周期 族。
(2)下列叙述正确的是 (填写序号)。
a.水的沸点比M高得多,是因为水分子间能形成氢键,而M分子间不能形成氢键
b.M的中心原子采用sp3杂化
c.N分子中含有6个σ键和1个大π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)已知C2D是一种麻醉剂,根据等电子原理可推知C2D的空间构型为 。
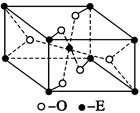
(4)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为 。
参考答案:(1)二(1分)VIA(1分)(2)ad(2分,漏选得1分,错选倒扣分,本空不出现负分)
(3)直线形(2分)(4)TiO2(2分)
本题解析:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同,短周期s区,只有ⅠA有单电子,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B原子电子排布式为1s22s22p2,故B为碳元素;D原子的核外成对电子对数与未成对电子数之比为3:2,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则D为O元素,M是甲醛,所以C为N元素;A、B两种元素组成的原子个数之比为1∶1的化合物N是常见的有机溶剂,则N是苯。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E的原子序数为18+4=22,为Ti元素,则
(1)氧元素在周期表中的位置是第二周期第ⅥA族。
(2)a.水的沸点比甲醛高得多,是因为水分子间能形成氢键,而M分子间不能形成氢键,a正确;b.甲醛是平面形结构,中心原子采用sp2杂化,b不正确;c.N分子中含有12个σ键和1个大π键,c不正确;d.CO2是分子晶体,二氧化硅是原子晶体,其熔点、沸点都比二氧化硅晶体的低,d正确,答案选ad。
(3)N2O与CO2互为等电子体,二氧化碳是直线形结构,则N2O也是直线形结构。
(4)由晶胞结构可知,晶胞中Ti元素数目为1+8×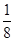 =2,O原子数目为2+4×
=2,O原子数目为2+4×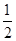 =4,故该氧化物的化学式为TiO2。
=4,故该氧化物的化学式为TiO2。
本题难度:一般
5、选择题 下列说法正确的是
A.由C、H、O、N四种元素组成的化合物一定是离子化合物
B.ⅠA族除氢元素外的所有元素的金属性比ⅡA族元素的金属性强
C.含有最高价元素的化合物不一定具有很强的氧化性
D.化学键存在于原子之间,也存在于分子之间
参考答案:C
本题解析:A、可能组成有机化合物,为共价化合物;
B、不一定,比如Ba的金属性比Li的金属性强;
C、正确,比如Na2CO3;碳+4价,最高价,没有有氧化性;
D分子间的为分子间作用力;不是化学键
本题难度:一般