微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列可用浓H2SO4干燥的气体有
①H2 ②SO2 ③H2S ④Cl2 ⑤NH3 ⑥HCl⑦CO2 ⑧HBr ⑨CO
A.①②④⑥⑧⑨
B.①②④⑥⑦⑨
C.①②④⑥⑦⑧
D.全部
参考答案:B
本题解析:浓H2SO4不能干燥碱性气体如NH3,也不能干燥还原性气体如H2S、HBr等。
本题难度:简单
2、选择题 将5.6gFe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH溶液立即产生沉淀,滴加至沉淀量最大时止,再将所得溶液和沉淀一起加热蒸干并在空气中灼烧至恒重,所得固体成分和质量可能为
A.A
B.B
C.C
D.D
参考答案:AB
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,或硝酸钠0.3mol,最后得到0.05mol氧化铁和0.2mol硝酸钠或0.3mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
解答:如果25.6gFe的物质的量=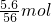 =0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
=0.1mol,铁全部恰好生成硝酸亚铁,则硝酸亚铁物质的量为0.1mol,加入氢氧化钠后蒸干,得到0.1mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.2mol硝酸钠,
根据元素质量守恒可得加热生成0.05mol氧化铁和0.2mol亚硝酸钠,
质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钠0.2mol×69g/mol=13.8g
如果恰好生成硝酸铁0.1mol,则氧化铁依然是0.05mol,硝酸钠是0.3mol,
灼烧生成氧化铁4g,根据N元素守恒可得亚硝酸钠0.3mol,质量为0.3mol×69g/mol=20.7g
所以氧化铁质量肯定是4g,亚硝酸钠质量应该在[13.8,20.7]区间内,
故选AB.
点评:本题考查混合物的计算,题目难度较大,本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解,注意加热氢氧化亚铁时生成氧化铁而不是氧化亚铁,为易错点.
本题难度:简单
3、选择题 下列反应,其产物的颜色按红色.红褐色.淡黄色.蓝色顺序排列的是
①金属钠在纯氧中燃烧; ②FeSO4溶液滴入NaOH溶液并在空气中放置一段时间 ;
③FeCl3溶液滴入KSCN溶液;? ④无水硫酸铜放入医用酒精中。
A.②③①④
B.③②①④
C.③①②④
D.①②③④
参考答案:B
本题解析:试题分析:①金属钠在纯氧中燃烧生成淡黄色的过氧化钠;②FeSO4溶液滴入NaOH溶液并在空气中放置一段时间 ,先产生白色沉淀,后逐渐变成黄绿色,最终变成红褐色沉淀。③FeCl3溶液中滴入KSCN溶液,发生络合反应,溶液呈红色;④无水硫酸铜放入医用酒精中,医用酒精中含有水,溶液变蓝,故其产物的颜色按红色.红褐色.淡黄色.蓝色顺序排列的是③②①④,故选B。
考点:本题考查物质的性质,题目难度不大,注意反应产物的判断,注意常见物质的颜色等物
理性质。
本题难度:困难
4、选择题 天然银耳本身为淡黄色,福建省一些县以银耳为原料,加工生产出一种雪耳,颜色洁白如雪.其制造过程如下:将银耳堆放在封闭得很好的塑料大棚内,在棚内一端支一口锅,锅内放入硫黄,加热使硫黄熔化并燃烧,两天左右,雪耳就制成了.用这种方法制得的雪耳不仅炖不烂,而且对人体也有危害.制作雪耳利用的是
A.硫的氧化性
B.硫的漂白性
C.SO2的氧化性
D.SO2的漂白作用
参考答案:D
本题解析:银耳由淡黄色转化为白色,说明有机色质被SO2漂白.
本题难度:困难
5、选择题 每做一次焰色反应实验,都要用一种试剂洗净铂丝,这种试剂是
A.稀盐酸
B.NaOH溶液
C.稀硫酸
D.Na2CO3溶液
参考答案:A
本题解析:分析:每做一次焰色反应实验,都要用稀盐酸洗涤铂丝,目的是除去杂质.
解答:因每做一次焰色反应实验,都要用稀盐酸洗涤铂丝,目的是除去杂质,这是由于氯化物的沸点低.
故选A.
点评:在做焰色反应实验,不能用稀硫酸洗铂丝,这是由于硫酸盐的沸点高,杂质不易除去.
本题难度:简单