微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量浓度为? (? ) ?
A.(b-a) /V mol·L-1
B.(2b-a)/V mol·L-1
C.2(b-a)/V mol·L-1
D.2(2b-a)/V mol·L-1
参考答案:D
本题解析:解:硫酸镁与氢氧化钠反应的方程式为: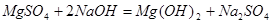 ,所以
,所以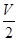 L混合溶液中
L混合溶液中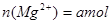 ;硫酸根离子与钡离子反应的离子方程式为:
;硫酸根离子与钡离子反应的离子方程式为: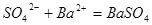 ,所以
,所以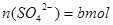 ;由于
;由于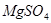 中
中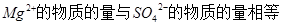 ;所以K2SO4中的硫酸根离子的物质的量为
;所以K2SO4中的硫酸根离子的物质的量为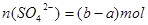 ,即
,即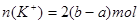 ,所以,原混合溶液中钾离子的物质的量浓度为2(2b-a)/V mol·L-1
,所以,原混合溶液中钾离子的物质的量浓度为2(2b-a)/V mol·L-1
本题难度:一般
2、选择题 将钠投入滴有石蕊的水中,下列有关现象的叙述中错误的是(? )
A.水溶液变成红色
B.钠熔化成小球并在水面上四处游动
C.有气体产生
D.钠浮在水面上
参考答案:A
本题解析:Na与水反应生成碱(NaOH),使紫色石蕊试液变蓝。
本题难度:简单
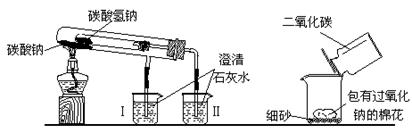
3、实验题 下图是两个实验装置(铁架台等辅助仪器略去未画)
 ?
?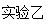
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是?(填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是:?,通过实验甲可比较出Na2CO3、NaHCO3两种固体,?更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧。写出Na2O2与CO2反应的化学方程式?,棉花能着火燃烧说明该反应特点是?。
(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分为?
参考答案:(1) Ⅱ,Ca2+ +2OH— +CO2=CaCO3↓+H2O,Na2CO3(2)2Na2O2+2CO2=2Na2CO3+O2;该反应能放出大量的热。(3)32.8%
本题解析:(1)碳酸钠加热不分解、碳酸氢钠受热分解产生碳酸钠、二氧化碳和水,二氧化碳使澄清石灰水变浑。(2)过氧化钠与二氧化碳反应放热。(3)4g沉淀为CaCO3,所以n(CO2)=0.04mol,n(NaHCO3)=0.08mol,碳酸氢钠质量分数为67.2%。
点评:碳酸钠比碳酸氢钠稳定,碳酸钠加热不分解,碳酸氢钠加热分解;过氧化钠与水及二氧化碳反应均放热。
本题难度:一般
4、简答题 某化学兴趣小组学习了CO2和Na2O2反应后,想探究SO2和Na2O2反应的情况.
①甲学生判断SO2和N来源:91考试网 91ExaM.orga2O2反应与CO2和Na2O2反应相似,有氧气生成,则该反应化学方程式______.
②乙学生判断SO2和Na2O2反应能生成硫酸钠,则该反应的化学方程式为______.
③该小组同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验.

装置D的作用是______.
④为确认反应产物,请完成下列实验表格
| 操?作 | 现象及结论
①确认是否有氧气生成:
②确认是否有硫酸钠生成:
参考答案:①CO2和Na2O2反应的化学方程式为2Na2O2+2CO2=Na2CO3+O2,甲学生判断SO2和Na2O2反应与CO2和Na2O2反应相似,有氧气生成,则反应方程式为甲学生判断SO2和Na2O2反应与CO2和Na2O2反应相似,有氧气生成,故答案为:2Na2O2+2SO2=Na2SO3+O2;
②由于Na2O2的强氧化性,S元素的化合价应由+4价升高到+6价,反应的化学方程式为Na2O2+SO2=Na2SO4,反应物氧气生成,
故答案为:Na2O2+SO2=Na2SO4;
③装置D有两个作用,一是吸收剩余的防止污染空气,二是防止空气中的水和二氧化碳进入,干扰实验,
故答案为:吸收剩余的防止污染空气,防止空气中的水和二氧化碳进入,干扰实验;
④为确认反应产物,
由操作①氧气可使带火星的木条复燃,可用用带火星的木条靠近干燥管末端,若木条复燃说明有氧气生成,反之则无氧气生成;
由操作②检验是否生成硫酸钠,可少量硬质管中的固体于试管中,加蒸馏水溶解加入盐酸酸化在滴入氯化钡溶液,若产生白色沉淀,则有硫酸钠生成,反之则无硫酸钠生成,
故答案为:操?作现象及结论用带火星的木条靠近干燥管末端若木条复燃说明有氧气生成,反之则无氧气生成取少量硬质管中的固体于试管中,加蒸馏水溶解加入盐酸酸化在滴入氯化钡溶液若产生白色沉淀,则有硫酸钠生成,反之则无硫酸钠生成.
本题解析:
本题难度:一般
5、选择题 在一定条件下,使CO和O2的混合气体 26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,则原混合气体中CO和O2的质量比可能是(?)
A.4∶9
B.1∶1
C.7∶6
D.6∶7
参考答案:C
本题解析:该过程发生的反应分别为2CO+O2=2CO2、2CO2+2Na2O2=2Na2CO3+O2,混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,由方程式可知,固体增加的质量相当于2CO的质量,14g/28g/mol=0.5mol,则混合物中,CO的物质的量为0.5mol,即14g,O2的质量为26g-14g=12g则原混合气体中CO和O2的质量比可能是7∶6,故选C。
点评:本题考查碳的氧化物的反应的计算,列出方程式,通过对比即可把握。
本题难度:一般
|