|
|
|
高中化学知识点讲解《盐类水解的原理》高频试题特训(2017年最新版)(二)
2017-07-10 20:15:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______ 。
参考答案:(1)__KOH___ (2)___Fe2O3_
本题解析:(1)K2CO3在水溶液里发生电离,电离出的CO32-发生水解,使溶液呈碱性,而加入少量KOH意在利用同离子效应,使得KOH电离出的OH-抑制CO32-的水解。
(2)FeCl3溶液中Fe3+发生水解,水解生成氢氧化铁和氯化氢,在持续加热的情况下,HCl不断挥发,平衡不断正向移动,最后剩余氢氧化铁,再灼烧,氢氧化铁分解失水,最后只剩Fe2O3固体。
本题难度:一般
2、填空题 (Ⅰ)水的电离平衡曲线如下图所示。
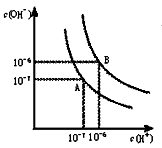
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将100℃下的pH=8的Ba(OH)2溶液与100℃下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
 (Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系: (Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
| (3)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(4)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系是c(NH4+) c(Cl-)。
参考答案:(1)10-14 , 10-12; (2)2∶9;
(3)氯化铵 ,A (4) NH4Cl和HCl
(5) < ,=
本题解析:(1)水的离子积Kw= c(H+)·c(OH-),根据表中数值,A点时c(H+)= c(OH-)=10-7mol/L,所以A点的 水的离子积是10-14,同理B点的水的离子积是10-6×10-6=10-12,所以从A到B点,水的离子积从10-14 增加到10-12;
(2)100℃的Kw=10-12,中性时pH=6,所以溶液pH=7,则溶液呈碱性,c(OH-)=10-5mol/L,设氢氧化钡溶液的体积是X,盐酸的体积是Y,100℃下的pH=8的Ba(OH)2溶液中c(OH-)=10-12/10-8=10-4mol/L,100℃下的pH=5的稀盐酸中c(H+)=10-5mol/L,则(10-4mol/L×X-10-5mol/L×Y)/(X+Y)= 10-5mol/L,解得X:Y=2:9;
(3)若溶液中只溶解了一种溶质,因为水电离产生氢氧根离子和氢离子,所以溶质只能是氯化铵,此时溶液呈酸性,铵根离子水解,所以氯离子浓度大于铵根离子浓度,则离子浓度的关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-),答案选A;
(4)若溶液中离子浓度大小顺序为c(Cl-)>c(H+)>c(NH4+)>c(OH-),说明溶液呈酸性,且氢离子浓度大于铵根离子浓度,说明该溶液的溶质为HCl和NH4Cl,且HCl的浓度大于氯化铵的浓度;
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,若二者等物质的量浓度,则反应后的溶液为氯化铵溶液,溶液呈酸性,现在溶液呈中性,则氨水的物质的量大于HCl的物质的量,所以混合前c(HCl)< c(NH3·H2O);混合后溶液呈中性,则c(OH-)=c(H+),根据电荷守恒,则c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+)。
考点:考查水的离子积的计算与应用,溶液中离子浓度的比较
本题难度:困难
3、选择题 已知草酸为二元弱酸:
H2C2O4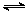 HC2O4-+H+ Ka1 HC2O4-+H+ Ka1
HC2O4-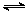 C2O42-+H+ Ka2 C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
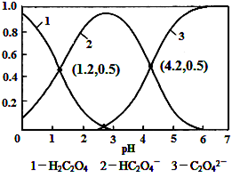
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
|
参考答案:C
本题解析:A、pH=1.2溶液中,电荷守恒:c(K+)+c(H+)=c(OH-)+c(HC2O4-),从图分析c(HC2O4-)=c(H2C2O4),所以有c(K+)+c(H+)=c(OH-)+c(H2C2O4),正确,不选A;B、根据电离平衡常数分析,K1=c(H+)c(HC2O4-)/c(H2C2O4)=10-1.2,K2=c(H+)c(C2O42-)/c(HC2O4-)=10-4.2,K1/K2=c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=10-1.2/10-4.2=1000,所以不选B;C、在pH=4.2时,c(C2O42-)=c(HC2O4-),溶液显酸性,说明草酸氢根的电离大于水解,所以当加入的草酸氢钾和草酸钾等物质的量加入时,电离大于水解后,二者的浓度不再相等,所以不可能配成pH=4.2的溶液,选C;D、从pH=1.2变到pH=4.2,溶液的酸性减弱,对水的电离抑制作用减弱,所以水的电离程度一直增大,不选D。
考点:溶液的酸碱性,盐类的水解,水的电离平衡
本题难度:困难
4、选择题 常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)…………………( )
A.溶液的pH值:②>③>①
B.水电离出的c(OH-):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:①、②、③分别是弱酸、强碱、盐 A对
水电离出的c(OH-)受①电离出H+、②电离出的OH-、③水解出的OH-的影响 B对
①和②反应生成水,溶液总质量增加,n不变,c一定变小,C 错
溶液的阴阳离子平衡,D对
本题难度:困难
5、选择题 NaHA是二元酸H2A的酸式盐,下列说法不正确的是 ( )
A.若NaHA溶液呈酸性,则H2A一定是强酸
B.若NaHA溶液呈碱性,则H2A一定是弱酸
C.NaHA溶液中Na+和HA-的个数之比一定大于1∶1
D.NaHA晶体中的阴阳离子个数比一定是1∶1
参考答案:A
本题解析:选项A错误,如H2SO3为弱酸,但其酸式盐溶液显酸性;若NaHA溶液呈碱性,则其水解程度大于电离程度,能水解则说明H2A一定是弱酸,B正确;由于HA-一定电离,也可能水解,C正确;D项正确。
本题难度:一般