微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有以下物质:
①NaCl晶体?②干冰?③液态的醋酸?④铜?⑤BaSO4固体?⑥蔗糖?⑦酒精? ⑧熔融的KNO3?⑨浓HNO3
回答下列问题(填序号);以上物质能导电的是______;以上物质属于非电解质的是______;以上物质属于电解质的是______.
参考答案:①NaCl晶体是电解质;②干冰是非电解质;③液态的醋酸是电解质;?④铜?能导电,既不是电解质也不是非电解质;?⑤BaSO4固体是电解质;?⑥蔗糖是非电解质;
⑦酒精是非电解质; ⑧熔融的KNO3是电解质且能导电;⑨浓HNO3是混合物,能导电.
故答案为:④⑧⑨;②⑥⑦;①③⑤⑧.
本题解析:
本题难度:一般
2、选择题 下列物质既能导电又属电解质的是
[? ]
A.硝酸钾溶液
B.硫酸铜晶体
C.熔融的氯化钠
D.无水乙醇
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则c(OH-)-c(HY)=c(H+)=1×10-5mol/L
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
参考答案:AD
本题解析:试题分析:根据盐的组成可知,溶质浓度相同时,硫酸铵溶液中的铵根离子浓度比氯化铵溶液中的大,而硫酸亚铁铵溶液中的铵根离子浓度比硫酸铵中小,因为亚铁离子的水解反应能抑制铵根离子的水解,则c(NH4+):(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl,反之,若三种铵盐溶液中c(NH4+)相等,硫酸亚铁铵浓度保持不变时,则氯化铵浓度增大的程度最大,硫酸铵浓度增大的程度其次,所以溶质浓度大小关系为c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A选项正确;由于n=c?V,则HY和NaOH的物质的量相等,二者恰好完全中和,生成NaY溶液,由于溶液pH=9,即溶液显碱性,说明NaY是强碱弱酸盐、HY是弱酸,相同,由于c(H+)=10—pHmol/L=10—9mol/L,Kw=c(H+)?c(OH-)=10—14,则该碱性溶液中的溶液中c(OH-)=Kw/c(H+)=10—5mol/L,由于NaY溶液中质子守恒关系式为c(OH-)=c(H+)+c(HY)= 10—5mol/L,故B选项错误;强酸与强碱混合时强酸过量,则混合后溶液中c(H+)= =
=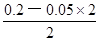 mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O
mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O
H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O![]() H2CO3+OH—、HCO3—
H2CO3+OH—、HCO3—![]() H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及盐类水解程度大小关系、盐溶液中质子守恒关系式、溶液的pH、水的离子积等。
本题难度:困难
4、选择题 某100 ml.溶液中含H2SO40.50 mol,加入下列物质,溶液导电性增强的是
[? ]
A.0.50 mol Ba(OH)2?
B.100 mL水
C.0.50molC2H5OH
D.0.50molNa2SO4
参考答案:D
本题解析:
本题难度:简单
5、填空题 凡是在水溶液里或熔化状态下能导电的化合物叫电解质,在水溶液和熔化状态下都不能导电的化合物叫非电解质。现有以下物质: ①二氧化碳 ②碳酸钙固体 ③Cu ④硫酸 ⑤乙醇 ⑥食盐水 ⑦石墨 ⑧苛性钾 ⑨NH3·H2O ⑩熟石灰。其中(填序号):
(1)属于电解质的是_________________;
(2)属于非电解质的是_________________;
(3)既不是电解质,也不是非电解质的是_________________。
参考答案:(1)②④⑧⑨⑩
(2)①⑤
(3)③⑥⑦
本题解析:
本题难度:简单