微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Na2CO3?10H2O与NaHCO3的混合物m?g溶解于水,配制成100mL溶液,测知溶液中Na+的质量m(Na+)=0.92g,若将溶液蒸干并加热至质量不变,可得固体的质量是
A.1.86g
B.2.55g
C.2.12g
D.无法确定
参考答案:C
本题解析:分析:将Na2CO3?10H2O与NaHCO3的混合物mg溶解于水,将溶液蒸干并加热至质量不变,最后得到的固体为Na2CO3,根据Na元素守恒可计算Na2CO3的物质的量,进而计算Na2CO3的质量.
解答:将Na2CO3?10H2O与NaHCO3的混合物mg溶解于水,将溶液蒸干并加热至质量不变,
NaHCO3加热分解生成Na2CO3,最后得到的固体为Na2CO3,
配制成100mL溶液,测知溶液中Na+的质量m(Na+)=0.92g,
则n(Na+)=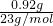 =0.04mol,
=0.04mol,
n(Na2CO3)= n(Na+)=0.04mol×
n(Na+)=0.04mol× =0.02mol,
=0.02mol,
m(Na2CO3)=0.02mol×106g/mol=2.12g,
故选C.
点评:本题考查混合物的计算,题目难度不大,本题注意加热后固体的成分的判断,根据Na元素守恒计算.
本题难度:一般
2、选择题 下列说法中不正确的是
A.置换反应一定是氧化还原反应
B.分解反应一定是氧化还原反应
C.复分解反应一定不是氧化还原反应
D.有单质参加的化合反应一定是氧化还原反应
参考答案:B
本题解析:分析:有电子转移的化学反应是氧化还原反应,由两种或两种以上的物质生成一种物质的反应是化合反应,由一种物质分解生成两种或两种以上物质的反应是分解反应,两种化合物相互交换成分生成另外两种化合物的反应是复分解反应,一种单质和一种化合物反应生成另外单质和化合物的反应是置换反应,据此分析解答.
解答:A.单质变为化合物或化合物变为单质,一定有电子的转移,所以一定是氧化还原反应,故A正确;
B.分解反应不一定是氧化还原反应,如CaCO3 CaO+CO2↑,故B错误;
CaO+CO2↑,故B错误;
C.复分解反应中各元素的化合价都不发生变化,所以一定不是氧化还原反应,故C正确;
D.有单质参加的化合反应,一定有元素化合价的变化,所以一定是氧化还原反应,故D正确;
故选B.
点评:本题考查了氧化还原反应、分解反应等概念,明确这几个概念之间的关系是解本题的关键,注意这几个概念的区别.
本题难度:一般
3、选择题 下列分子所有原子不可能处于同一平面的是
A.苯
B.乙烯
C.溴苯
D.甲苯
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列分子中所有原子都在同一条直线上的有机物是
A.C2H2
B.C2H4
C.C2H6
D.CO2
参考答案:A
本题解析:A中含有C,所有原子都在一条直线上,B中含CC,键角为120°,C为四面体型,D则是无机物.
本题难度:困难
5、选择题 将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色.将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列说法不正确的是
A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失
B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合
C.②红色褪去的原因是SO2具有漂白性
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
参考答案:C
本题解析:分析:A、根据高锰酸钾具有强氧化性,可以将SCN-氧化的原理来判断;
B、配位化合物中含有配位键;
C、二氧化硫能使品红褪色,根据漂白原理:适合有机色质的结合过程来回答;
D、高锰酸钾具有强氧化性,可以将还原性的离子氧化.
解答:A、三价铁离子遇到硫氰酸钾会发生络合反应:Fe3++2SCN-=[Fe(SCN)2]+,[Fe(SCN)]2+显红色,高锰酸钾具有强氧化性,可以将SCN-氧化,使[Fe(SCN)]2+的红色消失,故A正确;
B、[Fe(SCN)]2+属于配位化合物,[Fe(SCN)]2+中Fe3+与SCN-以配位键结合,故B正确;
C、二氧化硫只能漂白有机物,不能将Fe(SCN)]2+的红色漂白,故C错误;
D、高锰酸钾具有强氧化性,可以将SCN-氧化为(SCN)2,故D正确.
故选C.
点评:三价铁离子的检验以及高锰酸钾的氧化性知识是本题考查的重点,可以根据教材知识来回答,难度不大.
本题难度:一般