微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化工生产过程中不涉及氧化还原反应的是
A.氯碱工业
B.硫酸工业
C.玻璃工业
D.合成氨工业
参考答案:C
本题解析:略
本题难度:一般
2、填空题 (16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为?
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是??,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:?
?
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
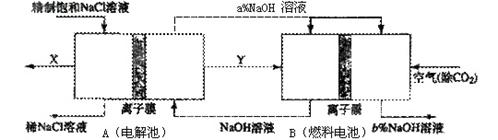 ?①分析比较图中氢氧化鈉质量分数大小:a%?(填“>”、“<”或“=”) b%,?理由是
?①分析比较图中氢氧化鈉质量分数大小:a%?(填“>”、“<”或“=”) b%,?理由是
?
②这样设计的主要节(电))能之处在于?(至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行??(填可行或不可行),理由是?
参考答案:(1)NaCl+H2O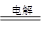 NaClO+H2↑
NaClO+H2↑
(2)H2和NaOH;? Cl2与水反应:Cl2+ H2O= HClO+HCl,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出
(3)①<;在B中右侧为燃料电池正极,氧气被还原产生OH-,同时Na+通过离子膜移到该侧,所以NaOH溶液浓度增大
②燃料电池可以补充电解池消耗的电能(或燃料电池提高了产出碱液的浓度,降低能耗等其他合理答案均可)
(4)可行;将发电厂产生的废气(SO2)与氯碱厂产生的Cl2或NaOH反应,既减少了SO2的排放,又可产生多种化学原料,同时就近联合还能减少电力输送中的损耗(其他合理答案均可)
本题解析:(1)生成物是次氯酸钠和氢气,所以总反应式为NaCl+H2O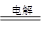 NaClO+H2↑。
NaClO+H2↑。
(2)惰性电极电极氯化钠溶液,阴极是氢离子放电,从而破坏阴极周围水的电离平衡,从而阴极溶液显碱性,即阴极生成物是氢气和氢氧化钠。阳极是氯离子放电生成氯气,由于Cl2与水反应:Cl2+ H2O= HClO+HCl,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
(2)①根据装置图可知,B中右侧通入空气,所以是正极,氧气被还原产生OH-,同时Na+通过离子膜移到该侧,所以NaOH溶液浓度增大。
②这样设计可以通过燃料电池来补充电解池消耗的电能。
(4)由于发电厂产生的废气(SO2)与氯碱厂产生的Cl2或NaOH反应,既减少了SO2的排放,又可产生多种化学原料,同时就近联合还能减少电力输送中的损耗,所以是可以的。
本题难度:一般
3、计算题 氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比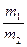 =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?
参考答案:(1)
(2)脱去水11t
(3)81t
本题解析:本题联系化学工业生产实际,要求学生根据题目提供的条件进行有关硝酸工业上需水量的计算。化学试题与社会生产、生活、科技等的紧密结合与联系,对于学生在化学学习中坚持理论联系实际,学以致用,特别是摆脱封闭式的应试教育的藩蓠,实施开放式、多种形式的素质教育,充分拓宽自己的视野,提倡自主学习、自我研讨与探索,在自我获取知识的过程中提高自学能力和思维能力,有着十分重要的作用。(1)氨氧化法制硝酸的总的化学方程式为:NH3+2O2=HNO3+H2O,由此式可知:17t NH3可生成HNO363t、H2O 18t。根据题意,由HNO3量可建立等式:m1×50%+m2×90%=63……①
由H2O量可建立等式:y= m1×50%+m2×10%—18……②
联立①②结合m1/m2=x,即可得: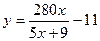 。
。
(2)解法1:只生成50%的HNO3时,50%的HNO3中含水为63t,因反应生成水为18t,所以需水为63-18=45t;只生成90%的HNO3时,90%的HNO3中含水为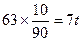 ,而反应生成水为18t,显然需脱去水18-7=11t。
,而反应生成水为18t,显然需脱去水18-7=11t。
解法2:根据 。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则
。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则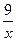 可视为0,
可视为0,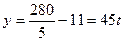 ;只生成90%的HNO3时,m1/m2=x中x为0,则
;只生成90%的HNO3时,m1/m2=x中x为0,则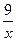 可视为无穷大,
可视为无穷大,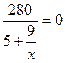 ,y=-11t,即需脱去11t水。
,y=-11t,即需脱去11t水。
(3)进出水平衡时,y=0。可得: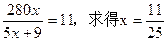 。设两种产品的总质量为w,则有:
。设两种产品的总质量为w,则有: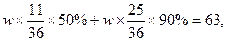 求得w=81t。
求得w=81t。
本题难度:简单
4、实验题 某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
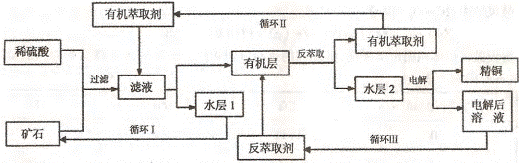
已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
?、?(写其中2个)
(2)将有机层和水层分离的操作方法叫?,实验式完成此操作所用到的一种主要仪器是?。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是?。
(4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式?
(5)“循环Ⅲ”中反萃取剂的主要成分是?
参考答案: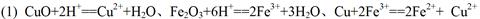
(任写出其中两个即给分,每空 3分,共 6分)
(2) 分液?分液漏斗?(各2分,共4分)
(3)FeSO4·7H2O? (2分,只写FeSO4得1分)
(4) Cu2+ + 2e- =" Cu?" (2分)
(5) H2SO4
本题解析:略
本题难度:简单
5、选择题 下列对硫酸生产中化学反应原理的分析正确的是? ( )。
A.硫酸生产中涉及的三个化学反应因原料的不同可能全部是非氧化还原反应
B.硫酸生产中涉及的三个化学反应都是放热反应
C.硫酸生产中涉及的三个化学反应都需要使用催化剂
D.硫酸生产中涉及的三个化学反应都需要在较高温度条件下进行
参考答案:B
本题解析:三个化学反应都是放热反应;三个反应中只有SO2―→SO3需使用催化剂;SO3―→H2SO4在常温下进行,且是非氧化还原反应。
本题难度:一般