微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。下列途径中,假设反应都能进行,从经济效益考虑最合理的反应是
[? ]
A.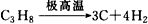
B.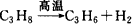
C.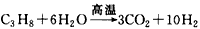
D.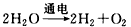
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列措施符合“绿色化学”思想的是( )
A.直接排放含磷生活污水
B.大量使用氟里昂作为冰箱制冷剂
C.使用可降解塑料代替不可降解塑料
D.使用化学性质稳定、不易分解的有机氯农药
参考答案:C
本题解析:
本题难度:一般
3、填空题 斯坦福大学R M. Trost教授提出了绿色化学的核心概念-原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率=
下面是新型自来水消毒剂ClO2的四种制取方法,请填空:
(1)氯酸钠和盐酸法:本方法的化学方程式为2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62. 2%,其阳极的电极反应式为ClO2--e- ==ClO2↑,阴极的电极反应式为____。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53. 6%,此反应的化学方程式为___。
(4)联合工艺法:本方法的反应原理由三步组成。
①电解热的氯化钠溶液:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯: 2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为______%(保留一位小数)。
参考答案:(1)37.6
(2)2H++2e-==H2↑(或2H2O+2e-==H2↑+2OH-)
(3)2NaClO2+Cl2=2NaCl+2ClO2
(4)94.4
本题解析:
本题难度:一般
4、选择题 下列有关工业上制硫酸和氨气的说法不正确的是
A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂
B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒
C.都进行了循环操作
D.都有热交换装置
参考答案:A
本题解析:A选项中SO2与O2常温常压下就可以反应,只是反应速率低了,转化率也低,加压降温有利于反应的发生。工业上制取SO3来制硫酸是,主要利用V2O5做催化剂,来催化氧化。由于加压需要一定的成本,且V2O5催化有较好的效果,所以一般不再加压和降温。B选项的条件正确。A、B的反应都需要循环操作和热交换装置来降低成本,所以C、D正确。
点评:本题结合生产实际,有时候符合化学原理的反应的条件不一定利用在实际中,因为还要考虑成本等因素,本题属于简单题。
本题难度:一般
5、选择题 合成氨工业有下列生产流程,其先后顺序为(?)
①原料气制备?②氨的合成?③原料气净化和压缩?④氨的分离
A.①②③④
B.①③②④
C.④③②①
D.②③④①
参考答案:B
本题解析:按合成氨工业流程,原料气制备→原料气的净化和压缩→合成氨→氨的分离是其正确的顺序。
本题难度:简单