微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在AlCl3和FeCl3混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是
[? ]
A.Fe(OH)3、Al(OH)3
B.Al(OH)3、I2
C.Fe2S3、I2
D.FeS、S、Al(OH)3
参考答案:D
本题解析:
试题分析:
在FeCl3和AlCl3溶液中加过量KI,先是FeCl3与KI两盐发生氧化还原反应:2Fe3++2I-=2Fe2++I2,反应完后溶液中含大量Fe2+、Al3+、I2,再加入Na2S后,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,Fe2++S2-=FeS↓;Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl;但由于I2的存在发生:I2+S2-=S↓+2I-或I2+H2S=S↓+2HI,所以最终得到的沉淀是FeS、Al(OH)3和S的混合物.
故选:D.
本题难度:一般
2、填空题 某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是
___________;若反应过程中转移了0.3电子,则氧化产物的质量是__________。
参考答案:NO;4.8g
本题解析:
本题难度:一般
3、填空题 (8分)以 ①2NaOH+ Cl2 NaCl+NaClO+H2O?② 2Na + Cl2
NaCl+NaClO+H2O?② 2Na + Cl2 2NaCl?
2NaCl?
③ 2Fe3+ + 2I– 2Fe2+ + I2? ④ 2Fe2+ + Br2
2Fe2+ + I2? ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–
这四个反应为例,我们来探究氧化还原反应。
(1)氧化还原反应的本质是?。
(2)对于反应①,氧化剂是?。
(3)对于反应②,Na的化合价由0价变成+1价,化合价升高的原因是?。
(4)由③、④两反应,可以推断Fe3+、Br2、I2的氧化性强弱顺序为?。
参考答案:(1)电子的转移(2)Cl2(3)失去了1个电子(4)Br2 >Fe3+>I2
本题解析:(1)氧化还原反应的本质是电子的得失或偏移。(2)根据方程式可知,Cl2的化合价降低,所以氧化剂是Cl2。(3))对于反应②,Na的化合价由0价变成+1价,是因为Na失去一个电子,化合价升高。(4)根据氧化剂的氧化性强于氧化产物的氧化性,所以可以推出氧化性Br2 >Fe3+>I2。
点评:本题属于氧化还原反应的基础试题,主要考的是氧化还原的基本概念。
本题难度:一般
4、填空题 金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是?
a.Fe2O3?b.NaCl? c.Cu2S? d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,该反应的还原剂是?,当1mol O2发生反应时,还原剂所失电子的物质的量为?mol。向CuSO4溶液中加入镁条时有气体生成,该气体是?
(3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为?
(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:
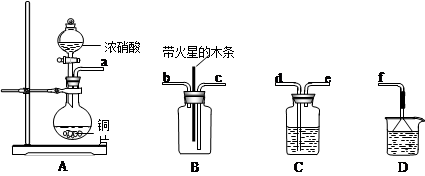
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。
②已知二氧化氮和碳反应生成两种物质的量比为1:1的有毒气体,则该反应的化学方程式为:___________________________。
参考答案:
(1)bd?(2)Cu2S(1分);4;氢气(1分)
(3)做电解质溶液,形成原电池。(4)①d→e→c→b(2分);
②NO2+C CO+NO(2分)
CO+NO(2分)
本题解析:(1)非常活泼的金属冶炼方法选择电解法,高中阶段需要掌握的钠、镁、铝是通过电解法获得;所以选bd,(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,Cu2S中铜元素+1价,硫元素-2价,CuSO4中铜元素+2价,硫元素-6价,化合价升高被氧化,做还原剂,氧气做氧化剂,得失电子守恒,1摩尔氧气化合价由0价降到-2价,化合价共降低4,所以还原剂此时失电子的物质的量为4摩尔,CuSO4溶液显酸性,镁和氢离子反应生成氢气。3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,是利用原电池原理,用铝置换出银,食盐水的作用为做电解质溶液,形成原电池。(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,首先反应制的二氧化氮,其中混有水蒸气,用浓硫酸干燥,然后再检验,导气管均为长进短出,最后用氢氧化钠吸收多余的二氧化氮,防止污染环境。
本题难度:一般
5、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4==2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
[? ]
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1molKClO3参加反应有2mol电子转移
D.H2C2O4在反应中被氧化
参考答案:D
本题解析:解析:
选项A.KClO3在反应中化合价降低,得到电子,故错;
选项B.ClO2是化合价降低后的产物,为还原产物,故错;?
选项C.1molKClO3参加反应有1mol电子转移,故错;
选项D.H2C2O4在反应中碳元素化合价升高,被氧化,故正确。
故选:D
本题难度:简单