微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下反应2NO2(g ) ? N2O4 ( g ) 已达到平衡,缩小此密闭容器的容积,则混合气体颜色的变化是
? N2O4 ( g ) 已达到平衡,缩小此密闭容器的容积,则混合气体颜色的变化是
A.变深
B.变浅
C.先变深再稍变浅
D.先变浅再稍变深
参考答案:C
本题解析:缩小此密闭容器的容积,气体的浓度都增大,二氧化氮是红棕色,颜色先变深,由于增大压强,平衡向气体体积减小的方向移动,即平衡右移,颜色会稍变浅,故选C 。
本题难度:一般
2、选择题 在一密闭容器中加入一定物质的量的A气体,发生反应 a A(g) b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是
A.化学计量数之间的关系:a>b+c
B.物质B的体积分数减小?
C.平衡向正反应方向移动
D.平衡移动过程中,与原平衡相比v正增大、v逆减小
参考答案:C
本题解析:在一密闭容器中加入一定物质的量的A气体,发生反应 a A(g) b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,假设平衡不移动,则,c(A)变为原平衡的50%,但是实际的情况是:当达到新的平衡时,c(A)变为原平衡的40%,说明平衡向正向移动了。故a<b+c;物质B的体积分数增大;平衡移动过程中,与原平衡相比v正、v逆都减小;故选C。
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,假设平衡不移动,则,c(A)变为原平衡的50%,但是实际的情况是:当达到新的平衡时,c(A)变为原平衡的40%,说明平衡向正向移动了。故a<b+c;物质B的体积分数增大;平衡移动过程中,与原平衡相比v正、v逆都减小;故选C。
点评:本题考查的是压强变化对化学平衡的影响,对反应前后体积变化的反应,加压,平衡朝着化学计量数小的那一方移动,加压相当于增加了反应物的浓度。 反之,向化学计量数大的那一方移动。当然这些得根据列夏特勒原理来判断。
本题难度:简单
3、填空题 大气固氮和合成氮是周氮的重要形式。下表是大气固氮和合成氨的部分K值:
?
| N2+O2 2NO 2NO
| N2+3H2 2NH3 2NH3
|
温度
| 25℃
| 2000℃
| 25℃
| 400℃
|
平衡常数K
| 3.84×10-31
| 0.1
| 5×108
| 200
|
?
(1)大气固氮是_______(“吸热”、“放热”)反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是______________________________________。
(2)工业合成氨原料气的制备主要方法如下:
①以空气为原料制备N2,其方法是______________________________________。
②以焦炭和水为原料制备H2,反应原理为____________________、__________________。
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:
CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0)
Cu(NH3)2AC·CO(aq)+Q(Q>0)
要从除杂后的溶液中“再生”出醋酸亚铜氨,可________(“升”“降”)温、____(“增”“降”)压。
(3)液氨和水类似,也能自离解(电离):NH3+NH3 NH4++NH2-。
NH4++NH2-。
①液氨的离子积可以表示为________________。
②25℃时,液氨的离子积K=1.0×10-30。若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)_________ (选填编号)
a.c(Na+)=c(NH2-)? b.c(NH4+)·c(NH2-)=1.0×10-30?c.c(NH2-)> c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为_______________________。
参考答案:(1)吸热(1分);寻找常温下能发生反应的催化剂(1分)。
(2)①将空气加压使其液化,然后蒸发(蒸馏),分离出氮气和氧气。(或将碳在空气中燃烧,除去CO2)(1分)。
②C(s)+ H2O (g) CO+ H2(1铃);CO+ H2O (g)
CO+ H2(1铃);CO+ H2O (g) CO2+ H2O(1分);升、降(2分)。
CO2+ H2O(1分);升、降(2分)。
(3)① K= c(NH4+)?c(NH2-)(1分)?②a(2分)
(4)NH4++ NH2-→2NH3(2分)
本题解析:(1)根据表中数据,温度升高,平衡常数增加,说明大气固氮是吸热反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是寻找常温下能发生反应的催化剂。
(2)①以空气为原料制备N2,其方法是将空气加压使其液化,然后蒸发(蒸馏),分离出氮气和氧气。(或将碳在空气中燃烧,除去CO2)。②以焦炭和水为原料制备H2,反应原理为C(s)+ H2O (g)=CO+ H2(1铃);CO+ H2O (g)=CO2+ H2O。CO(g)+Cu(NH3)2Ac(aq)  Cu(NH3)2AC·CO(aq)+Q(Q>0)正反应是放热反应, 要从除杂后的溶液中“再生”出醋酸亚铜氨,可升温降压,可使平衡左移即可。
Cu(NH3)2AC·CO(aq)+Q(Q>0)正反应是放热反应, 要从除杂后的溶液中“再生”出醋酸亚铜氨,可升温降压,可使平衡左移即可。
(3)NH3+NH3 NH4++NH2-。①液氨的离子积可以表示为K= c(NH4+)?c(NH2-)。②由于液氨能电离出NH2-,当加入NaNH2时电离出NH2-的量和钠离子的量肯定相等,但加上原NH2-时,就有c(Na+)<(NH2-) ,a错误;
NH4++NH2-。①液氨的离子积可以表示为K= c(NH4+)?c(NH2-)。②由于液氨能电离出NH2-,当加入NaNH2时电离出NH2-的量和钠离子的量肯定相等,但加上原NH2-时,就有c(Na+)<(NH2-) ,a错误;
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为NH4++ NH2-→2NH3。
本题难度:一般
4、选择题 对于可逆反应mA(g)+nB(g) 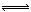 ?eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(C%)与温度(T)和压强(p)的关系如图所示.下列叙述正确的是
?eC(g)+fD(g),当反应过程中其他条件不变时,C的质量分数(C%)与温度(T)和压强(p)的关系如图所示.下列叙述正确的是
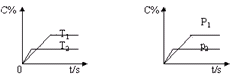
A.达到平衡后,若升高温度,化学平衡向逆方向移动
B.到平衡后,若使用催化剂,C的质量分数将增大
C.化学方程式中m+n>e+f
D.达到平衡后,增加A的量有利于化学平衡向正方向移动
参考答案:AD
本题解析:A正确,由图可知温度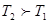 ,即升高温度C%减少,所以该反应的正反应方向为热反应,而逆反应为吸热反应;B错,加入催化剂平衡不移动,C的质量分数不变;C错,由图可知
,即升高温度C%减少,所以该反应的正反应方向为热反应,而逆反应为吸热反应;B错,加入催化剂平衡不移动,C的质量分数不变;C错,由图可知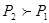 即增大压强,C%减小,得增大压强平衡向逆反应方向移动得m+n<e+f;D正确;
即增大压强,C%减小,得增大压强平衡向逆反应方向移动得m+n<e+f;D正确;
本题难度:简单
5、选择题 已知:2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
c/(mol·L-1)
| 0.8
| 1.24
| 1.24
|
?
下列说法正确的是(?)
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6 mol/L
③平衡时,反应混合物的总能量减少20 kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08 mol·L-1
A.①②④⑤?B.②⑥? C.②③④⑥?D.②④⑥
参考答案:B
本题解析:因为正反应为放热反应,升高温度平衡常数减小,①错;根据表格数据可知,反应转化生成的CH3OCH3、H2O浓度均为1.24 mol·L-1,此时CH3OH的浓度为0.8 mol·L-1,根据Qc=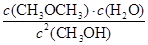 ,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。
,将各物质的浓度代入可得,Qc=2.4<400,所以此时没有达到平衡,此时反应向正反应方向进行,⑤错;由化学平衡常数计算可知平衡时c(CH3OCH3)=1.6 mol/L,②对;生成CH3OCH3的物质的量为1.6 mol,根据方程式可知生成1.6 mol×25 kJ·mol-1=40 kJ,③错;平衡时,再加入与起始等量的CH3OH,相当于增大压强,平衡不移动,CH3OH的转化率不变,④错;根据②可知,达到平衡时CH3OH的浓度为0.8 mol·L-1-0.72 mol·L-1=0.08 mol·L-1,⑥对。
本题难度:一般