微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
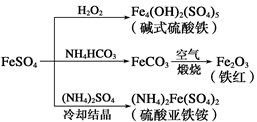
A.制备碱式硫酸铁利用了过氧化氢的氧化性
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质
参考答案:D
本题解析:A.在FeSO4溶液中Fe是+2价,在碱式硫酸铁中Fe是+3价,向FeSO4溶液中加入过氧化氢制备碱式硫酸铁就是利用了过氧化氢的氧化性。正确。B.NH4HCO3不稳定,受热容易分解,所以为防止NH4HCO3分解,在生产FeCO3需在较低温度下进行。正确。C.若(NH4)2Fe(SO4)2被氧化,则Fe的化合价由+2价变为+3价,检验Fe3+的方法是利用SCN-与Fe3+结合产生血红色的络合物的现象。正确。D.向FeSO4溶液中加入(NH4)2SO4晶体,冷却、结晶就可以产生(NH4)2Fe(SO4)2。是因为(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的溶解度小这一性质。错误。
本题难度:一般
2、选择题 水热法制备纳米颗粒Y(化合物)的反应为3Fe2+ + 2S2O32-+ O2 + aOH-== Y+S4O62-+2H2O,下列说法中,不正确的是?
A.a=4
B.Y的化学式为Fe2O3
C.S2O32-是还原剂
D.每有1 mol O2参加反应,转移的电子总数为4 mol w.^
参考答案:B?
本题解析:整个反应为:3Fe2+ + 2S2O32-+ O2 +4OH-== Fe3O4+S4O62-+2H2O,所以B错。
本题难度:一般
3、选择题 把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
A.稀H2SO4
B.CuSO4溶液
C.AgNO3溶液
D.Fe2(SO4)3溶液
参考答案:D
本题解析:考查金属铁的性质。铁和稀硫酸反应生成氢气和硫酸亚铁,A不正确。铁和硫酸铜反应生成铜和硫酸亚铁,溶液质量减小,B不正确。同样铁和硝酸银溶液反应生成银和硝酸亚铁,溶液质量减小,C不正确。铁和硫酸铁反应生成硫酸亚铁,溶液质量增加,D正确,答案选D。
本题难度:一般
4、选择题 关于FeCl3进行的实验,下列预测正确的是?(?)
选项
| 实?验
| 预?测
|
A
| 蒸发FeCl3溶液
| 得到FeCl3固体
|
B
| 在FeCl3、CuCl2混合液中,加入少量Fe粉
| 一定有H2产生且有Cu析出
|
C
| 用FeCl3固体溶于水配制饱和溶液
| 会有Fe(OH)3沉淀产生
|
D
| 在FeCl3溶液中,加入KHCO3溶液
| 有CO2产生,但无Fe(OH)3沉淀生成
参考答案:C
本题解析:A、得到的是Fe(OH)3固体,故错;B、无酸不会有H2产生,故错;D、发生双水解,有CO2产生,也有Fe(OH)3沉淀生成,故错。故选C。3的性质
点评:本题考查了的FeCl3实验的相关知识,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:一般
5、选择题 用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是
A.FeO
B.Fe2O3
C.CuO
D.Cu2O
参考答案:B
本题解析:
解:由关系式C0 ~CaCO3得,n(CaCO3)=60g/100g·mol-1=0.6mol=n(CO)
0.6molCO能还原A、72g/mol×0.6mol=43.2g;B、160 g/mol×0.6mol/3=32.0g符合题意;C、80 g/mol×0.6mol=48.0g;D、144 g/mol×0.6mol=86.4g
综上所述,正确答案为D
本题难度:一般
|