微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到 气体
气体
224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的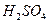 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:
?实验序号
| ? I
| ?Ⅱ
| ?Ⅲ
|
?加入钢样粉末的质量/g
| ? 2.812
| ? 5.624
| ? 8.436
|
?生成气体的体积/L(标准状况)
| ? 1.120
| ? 2.240
| ? 2.800
|
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
参考答案:(1)解:6.62g铁矿石中铁的质量为
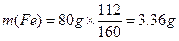
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)
答:至少需要这种铁矿石1.97t。
(2)
①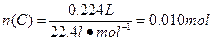 ?
?
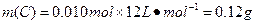
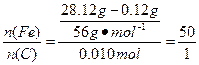
答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
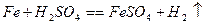
1mol? 22.4L
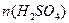 ? 2.800L
? 2.800L
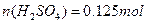

答:硫酸溶液的物质的量量浓度为
③当钢样粉末中的铁未全部溶解时( ),剩余的固体质量为:
),剩余的固体质量为:
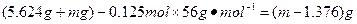
当钢样粉末中的铁全部溶解时( ),
),
剩余的固体质量为: ?
?
答:当铁未完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为
;当铁完全溶解时,剩余固体的质量为
本题解析:(1)解:6.62g铁矿石中铁的质量为
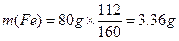
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)
答:至少需要这种铁矿石1.97t。
(2)
①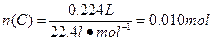 ?
?

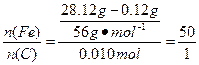
答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
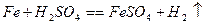
1mol? 22.4L
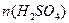 ? 2.800L
? 2.800L
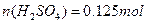

答:硫酸溶液的物质的量量浓度为
③当钢样粉末中的铁未全部溶解时( ),剩余的固体质量为:
),剩余的固体质量为:
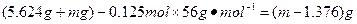
当钢样粉末中的铁全部溶解时( ),
),
剩余的固体质量为: ?
?
答:当铁未完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为
;当铁完全溶解时,剩余固体的质量为
本题难度:一般
2、选择题 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。已知Fe + 2Fe3+= 3Fe2+,Cu + 2Fe3+= 2Fe2++Cu2+。则原混合物中单质铁的质量是(?)
A.2.4 g
B.3.36 g
C.5.60 g
D.10.08 g
参考答案:C
本题解析:因有固体残余,没有Fe3+;故溶液只有FeCl2和过量HCl;根据氯离子守恒有n(FeCl2)=(0.1L×4.4mo/L-0.2L×0.4mol/L)÷2=0.18mol。产生氢气为0.04mol,故与之反应的铁为0.04mol;因有氢离子剩余,故1.28g为铜,与之反应的铁为0.02mol;在反应Fe + 2Fe3+= 3Fe2+中生成的Fe2+为0.18-0.04-0.02=0.12mol;则反应的铁为0.04mol。共有铁为0.04+0.04+0.02=0.1mol。
本题难度:简单
3、选择题 76.8mg铜与适量浓硝酸反应,铜全部作用后,如果NO3-离子减少2×10-3mo l,则溶液中H+离子同时减少?(?)
l,则溶液中H+离子同时减少?(?)
A.4.8×10-3mol
B.4.4×10-3mol
C.3.2×10-3mol
D.2.2×10-3mol
参考答案:B
本题解析:略
本题难度:简单
4、选择题 铜和镁的合金2.14 g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224 L。在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为(?)
A.4.18g
B.3.12g
C.4.68g
D.5.08
参考答案:A
本题解析:
正确答案:A
利用电子守恒,由硝酸生成NO2,NO,N2O所得电子总量为0.01mol×1+0.01mol×3+0.01mol×2×4=0.12mol;铜离子和镁离子所带正电荷为0.12mol,沉淀时消耗的氢氧根离子也为0.12mo;所得沉淀的质量为:2.14g+0.12mol×17g·mol-1=4.18g
本题难度:一般
5、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO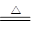 2Hg+O2↑。
2Hg+O2↑。
本题难度:简单