微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 I.某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图1:
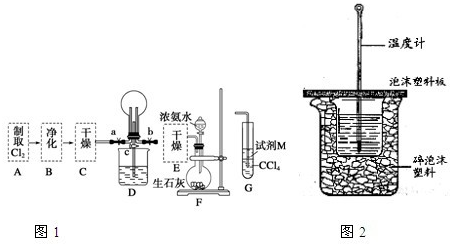
①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式______,试剂M为______溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是______.
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为______,反应一段时间后,关闭b打开c,观察到的现象为______.
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是______.
②使用补全仪器后的装置进行实验,取50mL?0.30mol/L?H2SO4溶液与50mL?0.65mol/L?NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L?NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=______,
③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热______ (填“相等”、“不相等”);若用50mL0.60mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会______ (填“偏大”、“偏小”、“不受影响”).
参考答案:I.①实验室用二氧化锰和浓盐酸在加热条件下制取氯气,反应离子方程式为MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
②氯气和氨气反应生成氯化氢和氮气,氯化氢和氨气相遇立即反应生成白烟氯化铵,所以看到的现象是黄绿色气体消失,产生白烟;反应一段时间后,关闭b打开c,烧瓶内气体压强小于空气压强导致烧杯中的液体进入烧瓶中,形成喷泉,
故答案为:黄绿色气体消失,产生白烟;烧杯中的液体进入烧瓶中,形成喷泉;
II.①环形玻璃搅拌棒起搅拌作用,使溶液温度一致,否则测量温度不准确,故答案为:环形玻璃搅拌棒;
②放出的热量Q=4.18J/(g?℃)×100g×4℃=1672J=1.672KJ,50mL0.30mol/L?H2SO4溶液与50mL0.65mol/L?NaOH溶液生成水的物质的量是0.03mol,所以生成1mol水放出的热量=1.672KJ0.03mol=55.7KJ/mol,故答案为:-55.7kJ?mol-1;
③中和热不随反应物量的多少变化,故相等;醋酸是弱电解质,醋酸的电离是吸热过程,所以导致溶液的温度偏小,故答案为:相等;偏小.
本题解析:
本题难度:一般
2、选择题 判断氧的非金属性比硫强的事实是(?)
A.氢硫酸敞口放置于空气中变浑浊
B.常温下Hg不与O2反应而与硫粉反应
C.Fe在氧气中燃烧生成Fe3O4,而与硫反应生成FeS
D.氧的游离态大量存在于空气中;而硫的游离态主要存在于火山口喷口处
参考答案:A、C
本题解析: 根据元素非金属性强弱的具体表现:氢化物的稳定性、还原性及生成的难易;最高价氧化物对应水化物酸性的强弱;非金属单质间的置换反应;使同种还原剂中元素化合价升高的多少等
根据元素非金属性强弱的具体表现:氢化物的稳定性、还原性及生成的难易;最高价氧化物对应水化物酸性的强弱;非金属单质间的置换反应;使同种还原剂中元素化合价升高的多少等
本题难度:一般
3、填空题 21在Fe + 2HCl ="=" FeCl2(氯化亚铁) + H2↑ 反应中。
② 此反应若转移了12mol的电子,则生成氢气 L(标准状况下).
参考答案:① Fe 元素被氧化, HCl 是氧化剂,氧化产物是 FeCl2 ;
② 134.4 L(标准状况)
本题解析:略
本题难度:一般
4、选择题 已知在某温度时发生如下三个反应:
(1)C+CO2=2CO
(2)C+H2O=CO+H2
(3)CO+H2O=CO2+H2
由此可以判断,在该温度下C、CO、H2的还原性强弱顺序是( )
A.CO>C>H2
B.C>CO>H2
C.C>H2>CO
D.CO>H2>C
参考答案:根据同一反应中还原性:还原剂>还原产物.
(1)C+CO2=2CO?中C的还原性大于还原产物CO;
(2)C+H2O=CO+H2中C的还原性大于还原产物H2;
(3)CO+H2O=CO2+H2中CO的还原性大于还原产物H2,综合上述得到还原性强弱:
C>CO>H2;
故选B.
本题解析:
本题难度:简单
5、填空题 将32gCu与一定浓度的硝酸混合,二者正好完全反应。产生的NO2、NO混合气体在标准状况下的体积为11.2 L。
(1)分别写出Cu和HNO3反应过程的化学方程式:
,
(2)反应过程中被还原的硝酸的物质的量是 mol
参考答案:(6分)(1)Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O (2)0.5 (3)0.5
本题解析:(1)稀硝酸的还原产物是NO,浓硝酸的还原产物是NO2,所以反应过程中的化学方程式分别是Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)还原产物的物质的量是11.2L÷22.4L/mol=0.5mol,则根据氮原子守恒可知,反应过程中被还原的硝酸的物质的量是0.5mol。
考点:考查铜与硝酸反应的有关计算以及方程式的书写
点评:该题是基础性试题的考查,试题注重基础,侧重对学生解题方法的指导与训练,难度不大,有助于培养学生的规范答题能力,提高学生的应试能力。该题的关键是利用好守恒法,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般