微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在8NH3+3Cl2=N2+6NH4Cl反应中,在该反应中氧化剂和还原剂的分子个数之比是:
A.3:1
B.3:8
C.3:2
D.8:3
参考答案:C
本题解析:试题分析:氧化剂是Cl2,还原剂是NH3,8 mol NH3参与反应,其中只有2mol NH3被氧化。
考点:氧化还原反应中氧化剂和还原剂的分析。
本题难度:困难
2、选择题 0.1mol·L-1 Na2S溶液,下列关系正确的是
A.c(Na+)=2c(S2-)
B.c(OH-)=c (H+)+c (HS-)+2c (H2S)
C.c(Na+) >c(S2-) >c (HS-) >c (OH-)
D.c(Na+)+c (H+)=2c (S2-)+c (HS-)+c (OH-)
参考答案:BD
本题解析:试题分析:A项错误,根据物料守恒:A中c(Na+)=2c(S2-)+2 c (HS-)+2c (H2S);B项是质子守恒关系式c(OH-)=c (H+)+c (HS-)+2c (H2S),正确;C项中应该c(Na+) >c(S2-) >c (OH-)>c (HS-) ,错误;D.c(Na+)+c (H+)=2c (S2-)+c (HS-)+c (OH-)这是电苛守恒表达式,正确;
考点:考查盐溶液中的通过三大守恒关系式判断离子的关系;
本题难度:简单
3、选择题 下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
A.NaCl(Na2CO3)加足量稀盐酸、蒸发、结晶
B.CaCl2(CaCO3)加足量稀硫酸、蒸发、结晶
C.Fe(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.MnO2(KCl)加足量水溶解、过滤、洗涤、干
参考答案:AD
本题解析:分析:本题为一种新形式的考题,先根据混合物组成成分的性质差别,分析选用的除杂试剂和实验操作,选择出能达到除杂目的选项,找出一个正确的除杂方法.
解答:A、碳酸钠可以和盐酸反应生成氯化钠、水以及二氧化碳,在蒸发结晶操作下,可以获得氯化钠晶体,故A正确;
B、碳酸钙和硫酸反应生成硫酸钙、水以及二氧化碳,这样会在氯化钙中混进硫酸钙杂质,故B错误;
C、金属Cu不和盐酸发生反应,单质金属铁可以和盐酸发生反应,这样可以将金属铁消耗掉,不符合除杂原则,故C错误;
D、二氧化锰是不溶于水的物质,氯化钾是易溶于水的,所以过滤可以获得二氧化锰固体,故D正确.
故选AD.
点评:依据所掌握的知识进行分析与判断,熟练常见物质的性质及有关使用的注意事项,可以帮助顺利完成此题.
本题难度:简单
4、选择题 贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2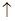 + SeO2+2H2O。下列叙述正确的是( )
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2