微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 配制0.1mol/L氢氧化钠溶液450mL,请按操作顺序[①、②、③…]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字.
______在盛有氢氧化钠的烧杯中注入一定的蒸馏水,用玻璃棒搅拌,使其溶解.
______待溶解的氢氧化钠溶液冷却后,沿玻璃棒注入______?mL的容量瓶中.
______用天平称取氢氧化钠______?克,放入烧杯中.
______用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
______往容量瓶中小心加入蒸馏水至液面接近刻度______cm处,改用______?加蒸馏水.至溶液液面恰好______.
参考答案:配制0.1mol/L氢氧化钠溶液450mL的步骤为:
①计算、称量,根据所配溶液体积,选择500mL容量瓶,氢氧化钠的质量=500mL×10-3L/mL×0.1mol/L×40g/mol=2g,用天平称取氢氧化钠2克,放入烧杯中;
②溶解,在盛有氢氧化钠的烧杯中注入一定的蒸馏水,用玻璃棒搅拌,使其溶解;
③移液,将冷却后的氢氧化钠溶液,沿玻璃棒注入500mL容量瓶中;
④洗涤,用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中;
⑤定容,往容量瓶中小心加入蒸馏水至液面接近刻度1~2处,改用胶头滴管滴加,溶液液面恰好与刻度线相切.
故答案为:排序②、③、①、④、⑤;
500;2;1~2;胶头滴管;与刻度线相切.
本题解析:
本题难度:一般
2、填空题 (6分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:
①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒
参考答案:
本题解析:
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.64g SO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L 的MgCl2溶液,含有Cl-数为NA
C.1mol H2O分子所含的核外电子总数为8NA
D.常温常压下,14g N2含有分子数为0.5NA
参考答案:D
本题解析:略
本题难度:简单
4、填空题 相同质量的氧气、二氧化碳、水,其中含分子数最多的是______;含氧原子数最多的是______.
参考答案:设质量都为m,则氧气的物质的量为m32mol,二氧化碳的物质的量为m44mol,水的物质的量为m18mol,所以含分子数最多的是水,相同质量时,含氧原子分别为,2×m32mol=m16mol,2×m44mol=m22mol,m18mmol,所以含氧原子最多的是氧气,故答案为:水;氧气;
本题解析:
本题难度:简单
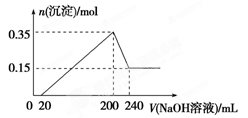
5、选择题 将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是(?)
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的稀硫酸
C.生成的氢气在标准状况下的体积为11.2 L
D.氢氧化钠溶液的物质的量浓度为5 mol·L-1
参考答案:C
本题解析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A.当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2.故n(Mg)=n[Mg(OH)2]=0.15mol,
m(Mg)=0.15mol×24g?mol-1=3.6g,
n(Al)=n[Al(OH)3]=0.35mol-0.15mol=0.2mol,
m(Al)=0.2mol×27g?mol-1=5.4g,所以镁和铝的总质量为9g,故A正确。
B.正确
C.再由Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4L?mol-1=10.08L,C错误。
D.从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,则此过程消耗n(NaOH)=n[Al(OH)3]=0.2mol,故c(NaOH)="0.2" mol0.04 L=5mol?L-1,故D正确。
故选C。
点评:本题考查镁铝的重要化合物,以图象题的形式考查,题目难度中等,注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用方程式计算
本题难度:简单