微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
A.乙烯的结 构简式为CH2CH2
B.乙醇的结构简式为C2H6O
C.丙烷的实验式为 C3H8
D.羟基的电子式: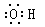
参考答案:C
本题解析:A.乙烯的结构简式为CH2=CH2; B.乙醇的结构简式为CH3CH2OH;C. 丙烷的实验式为 C3H8;D. 羟基的电子式: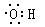 ,故选C。
,故选C。
点评:此题是高考的常考题型,题目交易,要求学生能熟练掌握基本的化学用语。
本题难度:一般
2、简答题 硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等.硝酸盐多用于焰火、试剂、图象处理行业.
(1)某金属M的硝酸盐受热时按下式分2MNO3
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL.由此可以计算出M的相对原子质量为______.
(2)将32.64g铜与140mL?一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L.其中NO的体积为______.
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况).则产物中硝酸铜的物质的量为______.如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为______.
参考答案:(1)设金属的相对原子质量为X.
2MNO3?△?.?2M+2NO2↑+O2↑气体的体积
2(X+62)g? 67.2L
3.40g? 0.672L
M=67.2L×3.40g0.672L×2-62=108
故答案为:108.
(2)设生成NO的体积为XL,则NO2的体积为(11.2-X)L,氧化还原反应中得失电子数相等列方程得:
32.64g64g/mol×2=XL22.4L/mol×3+(11.2-X)L22.4L/mol×1
X=5.82L
故答案为:5.82L.
(3)根据氮原子守恒知,参加氧化还原反应的硝酸根离子和一氧化氮的个数之比=1:1,所以生成224mLNO气体消耗硝酸根离子的物质的量=0.224L22.4mol/L=0.01mol,未参加反应的硝酸根的物质的量=0.6mol/L×0.1L-0.01mol=0.05mol,
设硝酸铜的物质的量为y.
Cu(NO3)2--2NO3-
1mol?2mol
y? 0.05mol
y=0.025mol
根据硝酸铜的化学式知,n(Cu 2+ )=C[Cu(NO3)2]=0.025mol;
设氧化亚铜的质量为Zg.
根据氧化还原反应中得失电子数相等得:
0.0lmol×2+Zg144g/mol×2=0.224L22.4mol/L×3
Z=0.72
根据铜离子守恒知,氧化铜的物质的量=氧化铜中铜的物质的量=0.025mol-0.01mol-0.01mol=0.005mol,所以氧化铜的质量=0.005mol×80g/mol=0.4g
所以氧化亚铜和氧化铜的质量比=0.72g:0.4g=9:5.
故答案为:0.025mol;?9:5.
本题解析:
本题难度:一般
3、选择题 下列化学用语说法正确的是
A.甲基的电子式: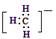
B.乙烯的比例模型:
C.质子数为53,中子数为78的碘原子: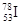
D.次氯酸的结构式:H─O─Cl
参考答案:D
本题解析:A、甲基不带电荷,电子式为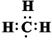 ,A不正确;B、该模型是乙烯的球棍模型,B不正确;C、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,则质子数为53,中子数为78的碘原子表示为
,A不正确;B、该模型是乙烯的球棍模型,B不正确;C、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,则质子数为53,中子数为78的碘原子表示为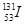 ,C不正确;D、次氯酸的电子式为
,C不正确;D、次氯酸的电子式为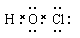 ,则结构式为H─O─Cl,D正确,答案选D。
,则结构式为H─O─Cl,D正确,答案选D。
本题难度:一般
4、简答题 26.在200mL稀硫酸和稀盐酸的混合溶液中,逐滴加入1mol-L-1?Ba(OH)2溶液,当加入0.6L?Ba(OH)2时,溶液恰好中性,共得到沉淀46.6g.试求
(1)SO42-刚好沉淀完全时滴加的Ba(OH)2溶液的体积是多少?
(2)混合酸溶液中硫酸和盐酸的物质的量浓度各是多少?
参考答案:(1)向混合溶液中加入逐滴加入1mol?L-1?Ba(OH)2溶液,发生的反应是H2SO4+Ba(OH)2=BaSO4 ↓+2H2O,2HCl+Ba(OH)2=BaCl2+2H2O,得到的46.6g沉淀为BaSO4 ,BaSO4 的物质的量为46.6g233g/mol=0.2mol,根据钡离子守恒可知,n[Ba(OH)2]=n(BaSO4 )=0.2mol,故SO42-刚好沉淀完全时滴加的Ba(OH)2溶液的体积为0.2mol1mol/L=0.2L,
答:SO42-刚好沉淀完全时滴加的Ba(OH)2溶液的体积0.2L;
(2)根据硫酸根守恒可知n(H2SO4)=n(BaSO4 )=0.2mol,混合酸溶液中硫酸的物质的量浓度为0.2mol0.2L=1mol/L,
溶液恰好为中性时,溶液中溶质为BaCl2 ,根据钡离子守恒n[Ba(OH)2]=n(BaSO4)+n(BaCl2 ),
故n(BaCl2 )=n[Ba(OH)2]-n(BaSO4)=0.6L×1mol/L-0.2mol=0.4mol,由氯离子守恒有n(HCl)=2n(BaCl2 )=2×0.4mol=0.8mol,混合酸溶液中盐酸的物质的量浓度为0.8mol0.2L=4mol/L,
答:混合酸溶液中硫酸的物质的量浓度为1mol/L,盐酸的浓度为4mol/L.
本题解析:
本题难度:一般
5、选择题 标准状况下,往100mL?0.1mol?L-1的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化.则通入的氯气的体积是( )
A.0.224?L
B.0.336?L
C.0.448?L
D.0.672?L
参考答案:n(FeBr2)=0.1mol/L×0.1L=0.01mol,根据化学式知,溴化亚铁溶液中n(Fe2+)=n(FeBr2)=0.01mol,n(Br-)=2n(FeBr2)=0.02mol,设和亚铁离子反应的氯气体积为x,和溴离子反应的氯气体积为y.
2Fe2++Cl2=2Fe3++2Cl-
2mol?22.4L
0.01mol x
x=22.4L×0.01mol2mol=0.112L
2Br-+Cl2=Br2+2Cl-
2mol?22.4L
0.01mol y
y=22.4L×0.01mol2mol=0.112L
所以共需氯气的体积为x+y=0.112L+0.112L=0.224L.
故选A.
本题解析:
本题难度:一般