微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙是周期表中同一主族的两种元素,若甲原子序数为x,则乙的原子序数不可能是(?)
A.x+2
B.x+4
C.x+8
D.x+18
参考答案:B
本题解析:考查元素周期表的结构。根据每周期中容纳的电子数可判断,同主族元素原子序数相差可以是2、8、18或32,所以答案选B。
本题难度:简单
2、选择题 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是(?)?
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.134
| 0.089
| 0.102
| 0.074
|
主要化合价
| +2
| +3
| +2
| +6、-2
| -2
|
A.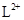 与
与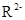 的核外电子数相等
的核外电子数相等
B.L与T形成的化合物具有两性
C.氢化物的稳定性为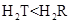
D.单质与浓度相等的稀盐酸反应的速率为Q<L
参考答案:D
本题解析:由表可以退出L为Mg,M为Al,Q为Be,R为S,T为O,很快可以排除A,B中,L与T形成的化合物为MgO,并没有两性,故错误;C中,因为T和R为同一族,氢化物的稳定性由上到下降低,故错误;D中,Q和L为同一族,还原性由上到下增强,故与酸反应,速率加快,故Q<L。
点评:此题考核了短中期元素的推导及性质判断,属于中等难度。
本题难度:简单
3、填空题 有两种气体单质Am和Bn,已知2.4克Am和2.1克Bn所含有的原子个数相同,分子个数比为2:3;又知A和B的原子核内质子数都等于中子数,且A原子中的L层电子数是其K层电子数的3倍,则A元素的元素符号为________,B元素的元素符号为_________,m=_________;A和B形成红棕色化合物化学式为_________。
参考答案:O,? N,? 3,? NO2
本题解析:A原子中的L层电子数是其K层电子数的3倍,所以A是氧元素
2.4克Am和2.1克Bn所含有的原子个数相同
则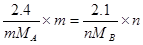
解得
所以MB=14
由于B的原子核内质子数都等于中子数
所以B是氮元素,二者的形成的红棕色化合物是NO2
又因为分子个数比为2:3
所以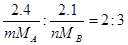
则m:n=3:2
因为n=2
所以m=3
点评:该题是基础性试题的考查,难度不大。试题设计新颖,基础性强,注重答题的灵活性,有利于培养学生的规范答题能力,提升学生的学科素养。该题的突破点是A元素的判断。
本题难度:一般
4、填空题 (4分)碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:
CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
X属于?晶体(填晶体类型)。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有?个。
②石墨晶体能导电,导电的粒子是?。
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断电负性:Si?H(填“>”、“<”或“=”)
参考答案:(4分,每空一分)(1)离子 (2)①3?②自由电子(3)<
本题解析:(1)根据原子守恒可知,X应该是碳酸钠,属于离子晶体。
(2)①根据构造原理可知,基态Cr3+离子核外电子排布式是1s22s22p63s23p63d3,所以基态Cr3+离子中未成对电子数有3个。
②石墨晶体中含有自由电子,所以可以导电。
(3)根据反应的方程式可知,氢元素失去电子,被氧化。这说明SiH4中氢元素显负价,Si元素显正价,所以硅元素的大发展小于氢元素的。
点评:该题是高考中的常见题型,试题难易适中,注重基础和能力的双向考查。该题的难点在于(3)问,该题有利于培养学生的逻辑思维能力,以及灵活应变能力。
本题难度:一般
5、填空题 VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为?。
(2)N、P、As原子的第一电离能由大到小的顺序为?。
(3)NH3的沸点比PH3高,原因是?;PO43-离子的立体构型为?。
(4)PH3分子中P原子采用??杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因?。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为?。
参考答案:(1)1s22s22p63s23p63d104s24p3?
(2) N>P>As
(3) NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力?正四面体
(4) sp3杂化?
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中O的电子更向As偏移,更易电离出H+
(6) 16mol或16×6.02×1023个
本题解析:(1)砷是33号元素,其核外电子排布为,1s22s22p63s23p63d104s24p3 ;?
(2)非金属性越强,第一电离能越大,N>P>As;
(3)NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力;PO43-是AB4型分子,所以空间构型是正四面体。
(4)P原子中孤对电子对数=(5-3)/2=1,即P采取的是sp3杂化。
(5)两种含氧酸即可改写为(HO)mROn),H3AsO4可表示为(HO)3AsO,H3AsO3可表示为(HO)3As,H3AsO4中n值大正电性强,导致As-O-H中O的电子更向As偏移,更易电离出H+,所以H3AsO4比H3AsO3酸性强。
(6)1mol配合物[Cu(NH3)4]Cl2中,1mol氨气中含有3molσ键,总共含有σ键的物质的量为:3mol×4=12mol,1mol该配合物中含有4mol配位键,所以含有的σ键的物质的量为:12mol+4mol=16mol,或者16×6.02×1023个。
本题难度:一般