微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是?;
淡黄色固体F中含有的化学键是?。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
??。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
??。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为:? 。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为:??。(用化学式表示)
参考答案:(每空2分,共12分)
(1)第二周期、第IVA族(答不全不得分) ; 离子键、非极性共价键(答不全不得分)
(2)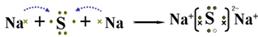
(3)Al(OH)3+ OH- = AlO2-+2H2O
(4)S2—>Cl—>Na+>Al3+
(5)HCl>H2S>SiH4
本题解析:根据Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F,F为Na2O2,Q为O,A为Na。根据A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,B为Al,Z为Cl。根据X元素的最外层电子数比次外层电子数少4,X为Si。根据W与X在同一主族,W为C。根据Y元素的L层电子数等于K、M两个电子层上的电子数之和,Y为S。
(1)W为C,故在周期表中的位置是第二周期、第IVA族。
淡黄色固体F为Na2O2,含有的化学键是离子键、非极性共价键。
(2)A与Y两元素形成化合物为Na2S,电子式表示此化合物的形成过程为 。
。
(3)A、B两元素的最高价氧化物的水化物分别为NaOH,Al(OH)3,反应的离子方程式为Al(OH)3+ OH- = AlO2-+2H2O。
(4)A、B、Y、Z四种元素的简单离子的离子分别为Na+、Al3+、S2—、Cl—,电子层数越多,半径越大;具有相同电子排布的离子,核电核数越大半径越小。故离子半径由大到小的顺序为S2—>Cl—>Na+>Al3+。
(5)X、Y、Z三种元素的氢化物分别为SiH4、H2S、HCl,元素的非金属性越强,对应其氢化物的稳定性越强,故氢化物的稳定性由强到弱的顺序为HCl>H2S>SiH4?。
点评:本题考查原子的符号,电子式,化学方程式的书写,难度不大。
本题难度:一般
2、选择题 我国的“神州五号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法不正确的是
A.42He原子核内含有2个质子
B.32He和42He互为同位素
C.32He原子核内含有1个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
参考答案:D
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,所以选项A、C都是正确;质子数相同而中子数不同的同一种元素的不同核素互为同位素,所以B正确;He是稀有气体元素,没有很强的金属性,选项D不正确,答案选D。
本题难度:一般
3、选择题 下列关于电子层及该层所能容纳的电子数,不正确的是
A.K∶2
B.M∶18
C.N∶32
D.O∶50
参考答案:D
本题解析:在已发现的元素中,O层可为倒数第三层,容纳电子数最多,根据核外电子排布规律,倒数第三层不超过32。
本题难度:一般
4、选择题 下列粒子中与Na+电子数和质子数都相等的是?(?)
A.OH-
B.NH4+
C.H2O
D.O2-
参考答案:B
本题解析:Na+电子数和质子数分别是10和11,A中电子数和质子数分别是10和9,B中电
子数和质子数分别是10和11,C中电子数和质子数分别是10和10,D中电子数和质子数分
别是10和8,答案选B。
点评:该题是高考中的常见题型和重要的考点,属于基础性试题的考查。试题基础性强,侧
重对学生基础性知识的巩固与训练。该题的关键是明确质子数与电子数的计算方法,然后结
合题意灵活运用即可,难度不大。
本题难度:简单
5、选择题 1934年居里夫妇用α粒子(4He)轰击27Al得到一种自然界不存在的磷元素的一种同位素(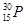 ):
): +
+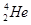 ―→
―→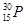 +
+ ,开创了人造核素的先河。下列有关说法不正确的是
,开创了人造核素的先河。下列有关说法不正确的是
A.该变化说明原子核在一般的化学反应中也能发生变化
B.该变化同样遵循质量守恒定律
C. 是一种电中性粒子
是一种电中性粒子
D.对于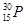 有:原子序数=质子数=中子数=核外电子数
有:原子序数=质子数=中子数=核外电子数
参考答案:A
本题解析:化学反应中原子核是不变的,只有核反应中原子核中才发生变化,核反应也遵守质量守恒定律; 代表中子,是电中性的粒子;
代表中子,是电中性的粒子;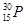 中,原子序数=质子数=中子数=核外电子数=15,故选A。
中,原子序数=质子数=中子数=核外电子数=15,故选A。
本题难度:一般