微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 元素的分区和族
(1)s 区: ,最后的电子填在_______上,包括_________,属于活泼金属,为碱金属和碱土金属;
,最后的电子填在_______上,包括_________,属于活泼金属,为碱金属和碱土金属;
(2)p区: ;最后的电子填在_______上,包括_______族元素,为非金属和少数金属;
;最后的电子填在_______上,包括_______族元素,为非金属和少数金属;
(3)d区: ,最后的电子填在_______上,包括_______族元素,为过渡金属;
,最后的电子填在_______上,包括_______族元素,为过渡金属;
(4)ds区: ?, (n-1)d全充满, 最后的电子填在_______上,包括_______,过渡金属(d和ds区金属合起来,为过渡金属);
?, (n-1)d全充满, 最后的电子填在_______上,包括_______,过渡金属(d和ds区金属合起来,为过渡金属);
(5)f区: ,包括_______元素,称为内过渡元素或内过渡系。
,包括_______元素,称为内过渡元素或内过渡系。
参考答案:(1)ns;IA和IIA族元素
(2)np;IIIA-VIIA族、零族元素
(3)(n-1)d;第IIIB族到VIII族元素
(4)ns;IB族和IIB族元素
(5)镧系和锕系元素
本题解析:
本题难度:一般
2、选择题 元素周期表中ⅢA族的一种元素A与ⅥA族的一种元素B化合,下列情况不可能的是
A.形成A3+和B2-
B.形成化合物的化学式是A2B3
C.形成的化合物在常温下是气体
D.形成共价化合物
参考答案:C
本题解析:ⅢA的金属和ⅥA的非金属形成金属化合物,常温下不可能为气体.
本题难度:一般
3、简答题 下表是周期表中的一部分,请回答下列问题:

(1)A是④的最高价含氧酸,其化学式为______,A中所含的化学键类型为______.
(2)将③对应的单质投入A的稀溶液中,发生的反应属于______?反应(填“吸热”或“放热”),该反应中反应物的总能量______生成物的总能量(填“大于”或“小于”);若将③对应的单质和铁用导线连接后投入A的稀溶液中,组成的装置中能量转化形式主要是______,该装置正极材料是______.
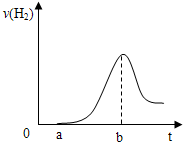
(3)把在空气中久置的③的单质投入A的稀溶液中,产生氢气的速率与反应时间的关系可用如图曲线表示:
曲线0→a段不产生氢气的原因是______,曲线a→b段产生氢气速率逐渐增大的主要原因是______,
曲线由b以后产生氢气速率逐渐减小的主要原因是______.
(4)①和②对应的单质在一个固定体积的密闭容器中发生可逆反应,该反应达到平衡的标志是______(请列举一项).
参考答案:由元素在周期表中的位置可知,①为H,②为N,③为Al,④为S,
(1)硫元素最高价含氧酸是H2SO4,属于共价化合物,含有共价键,
故答案为:H2SO4;共价键;
(2)Al与稀硫酸的反应是放热反应,故反应物的总能量大于生成物的总能量;
若Al和铁用导线连接后投入硫酸的稀溶液中,组成原电池,化学能转化为电能,Al较活泼作负极、Fe较不活泼作正极,
故答案为:放热;大于;化学能转化为电能;Fe;
(3)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成致密的氧化铝膜,限制了铝与H2SO4的反应,氧化铝首先稀硫酸反应生成氯化铝和水,不产生H2;
金属和酸的反应是放热反应,使溶液的温度升高,曲线a→b段温度升高是影响反应速率的主要因素,化学反应速率加快;
随着反应的进行,溶液中的氢离子浓度逐渐降低,曲线由b以后氢离子浓度是影响化学反应速率的主要因素,所以反应速率逐渐减小;
故答案为:铝表面被O2氧化为致密的氧化膜,限制了铝与H2SO4的反应;反应放热,温度升高是影响反应速率的主要因素,使反应速率增大;随反应c(H+)减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降;
(4)可逆反应到达平衡时,正逆反应速率相等,各成分的浓度(或质量、物质的量、压强等)不再变化,
故答案为:各成分的浓度(或质量、物质的量、压强等)不再变化.
本题解析:
本题难度:一般
4、选择题 A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为( )
A.ⅠA、ⅤA
B.ⅠA、ⅦA
C.ⅣA、ⅥA
D.ⅡA、ⅦA
参考答案:化学式为AB2型的分子中,A的化合价可能为+2或+4价,B的化合价可能为-1或-2价,则
A.ⅠA族的化合价为+1价,ⅤA族的化合价可能为+5价或-3价,二者形成的化合物为BA3,故A错误;
B.ⅠA族的化合价为+1价,ⅦA族的化合价可能为+7价或-1价,二者形成的化合物为AB,故B错误;
C.ⅣA族的化合价可能为+2或+4价,ⅥA族的化合价可能为+4、+6价或-2价,二者形成的化合物能以共价键结合成化学式为AB2型分子,如CO2、CS2,故C正确;
D.ⅡA族的化合价为+2价,为金属元素,,ⅦA族的化合价可能为+7价或-1价,二者能形成化学式为AB2型物质,但为离子化合物,以离子键结合,故D错误.
故选C.
本题解析:
本题难度:一般
5、填空题 下表列出了①~⑥六种元素在周期表中的位置:请按要求回答下列问题:

(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是_________(填写化学式)。
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为_____>_____>_____(用元素符号表示)。
(3)元素①的气态氢化物的电子式是___________。
(4)元素③的原子结构示意图是___________。元素⑤的单质晶体的导电性介于导体和绝缘体之间,因此是一种良好的____________材料。
(5)在盛有水的小烧杯中滴加几滴酚酞溶液后加入元素②的单质,发生反应的离子方程式为____________。
参考答案:(1)NaOH?
(2)K?Na?Mg?
(3) ?
?
(4) ;半导体?
;半导体?
(5)2Na?+?2H2O?===?2Na+?+?2OH-?+?H2↑
本题解析:
本题难度:一般