微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是(?)
A.用碳酸钠溶液吸收少量二氧化硫:2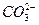 +H2O+SO2====2
+H2O+SO2====2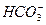 +
+
B.碳酸氢铵溶液的电离方程式: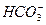
 H++
H++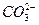
C.向含有2 mol FeBr2的溶液中通入1 mol氯气:2Fe2++Cl2====2Fe3++2Cl-
D.NaHS溶液的水解:HS-+H2O H2S↑+OH-
H2S↑+OH-
参考答案:AC
本题解析:B中碳酸氢铵溶液的电离方程式可写成:NH4HCO3===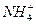 +
+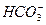 ,
,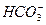
 H++
H++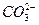 。D中NaHS溶液的水解,因为水解程度很小,没有硫化氢气体放出,书写水解方程式时不用气体符号。C项中FeBr2溶液中存在Fe2+和Br-,Fe2+的还原性大于Br-的还原性,在Cl2不足时,应先氧化Fe2+。
。D中NaHS溶液的水解,因为水解程度很小,没有硫化氢气体放出,书写水解方程式时不用气体符号。C项中FeBr2溶液中存在Fe2+和Br-,Fe2+的还原性大于Br-的还原性,在Cl2不足时,应先氧化Fe2+。
本题难度:简单
2、选择题 HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+c(H+)=c(A-)+c(OH-)
参考答案:D
本题解析:A、HA是弱酸,则在0.1 mol·L-1 NaA溶液中A-水解,溶液显碱性,则溶液中离子浓度大小关系是c(Na+)>c(A-)>c(OH-) >c(H+),A不正确;B、由于A-水解程度很小,所以溶液中c(A-)>c(OH-),B不正确;C、根据电荷守恒可知,c(Na+)+c(H+)=c(A-)+c(OH-),所以C不正确;D、根据电荷守恒可知,c(Na+)+c(H+)=c(A-)+c(OH-),D正确,答案选D。
本题难度:一般
3、选择题 常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+ c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 ml
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
参考答案:C
本题解析: A、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A错误;B、当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故B错误;C、根据物料守恒得c(Na+)浓度最大,故C正确;D、根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故D不正确,答案选C。
本题难度:一般
4、填空题 (1)向FeCl3溶液中投入适量的Zn粉,会有?放出(填化学式)。
(2)室温下,向氨水中滴加盐酸,当溶液呈中性时,C(NH4+)?C(Cl- )(填< 或>或=)
(3)盐的水解反应为吸热反应,升高温度水解程度?(填增大或减小或等于)
(4)写出Na2CO3溶液中的电荷守恒式?
参考答案:(1)H2。(2)==? (3)增大
(4)c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
本题解析:略
本题难度:简单
5、选择题 对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是?
A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-]
C.[OH-]=[H+]+[HCO3-]+[H2CO3]
D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1
参考答案:A、D
本题解析:碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程:
Na2CO3====2Na++CO32-
CO32-+H2O HCO3-+OH-
HCO3-+OH-
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
故溶液中存在的微粒有Na+、H+、OH-、CO32-、HCO3-、H2CO3等,它们的浓度关系:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]。按电荷守恒分析其浓度关系:
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
按物料守恒分析其浓度关系:
[Na+]=[CO32-]+[HCO3-]+[H2CO3]
∵[Na+]=0.2mol·L-1,?∴[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1。
本题难度:一般