微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图所示的实验装置不能达到实验目的的是?
[? ]
A.?结合秒表测量锌与硫酸的反应速率 
B.?测定中和反应的反应热 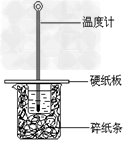
C.?验证化学能转化为电能 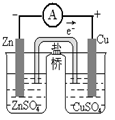 ?
?
D.?验证催化剂对反应速率的影响 
参考答案:B
本题解析:
本题难度:一般
2、实验题 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验时按以下步骤进行:
①称量a g样品,置于烧杯中
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250 mL溶液
③准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全
⑤过滤,洗涤沉淀
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量
⑦……
请根据上面叙述,回答:
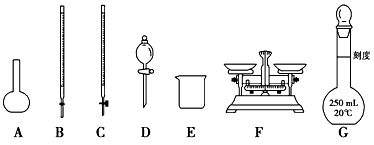
(1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E和________(填字母)。
(2)写出步骤③中发生反应的离子方程式________。
(3)洗涤是洗去附着在沉淀上的________(写离子符号),洗涤沉淀的操作是______________。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1 g;再次加热并冷却至室温称量其质量为m2 g,且m1-m2=0.3,接下来的操作应当是______________________。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为_______。 (列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的。你认为甲学生的观点是否正确?________(填“正确”或“错误”),请说明理由:________________。
参考答案:(1)CFG
(2)2Fe2++Cl2==2Fe3++2Cl-
(3)NH4+、Cl-、OH-;向漏斗里注入蒸馏水,使水面没过滤渣,水自然流完后,重复操作2~3次
(4)继续加热,放置于干燥器冷却,称量,至最后两次称得的质量差不超过0.1 g为止
(5)
(6)正确;FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在⑥操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响
本题解析:
本题难度:一般
3、简答题 有一包白色粉末,可能由KCl、BaCO3、BaCl2、KNO3、NH4NO3和Na2SO4中的一种或几种组成.现进行下列实验:
(1)将此粉末溶于水中,得到无色透明溶液A及白色沉淀B,过滤.
(2)取沉淀物B,加稀HNO3后,沉淀物B不溶解.
(3)取少量溶液A,加入适量的NaOH溶液,加热,产生无色有刺激性气味并能使湿润的红色石蕊试纸变蓝色的气体.
(4)再取少量溶液A,滴入AgNO3溶液,充分反应后,有白色沉淀生成,该沉淀不溶于稀硝酸.
据此推断,该白色粉末中,一定含有______,肯定不含有______,可能含有______.
参考答案:(1)将此粉末溶于水中,得到无色透明溶液A及白色沉淀B,该沉淀可能为BaCO3或BaSO4,或二者都有;
(2)取沉淀物B,加稀HNO3后,沉淀物B不溶解,说明沉淀为BaSO4,不含BaCO3,则一定有BaCl2和Na2SO4;
(3)取少量溶液A,加入适量的NaOH溶液,加热,产生无色有刺激性气味并能使湿润的红色石蕊试纸变蓝色的气体,生成的气体为氨气,则应含有NH4NO3;
(4)再取少量溶液A,滴入AgNO3溶液,充分反应后,有白色沉淀生成,该沉淀不溶于稀硝酸,该沉淀为AgCl,由于含有,则不能确定是否有KCl;
由于和任何物质都不反应,则不能确定是否有KNO3,
则一定含有:BaCl2、Na2SO4、NH4NO3;肯定不含有:BaCO3;可能含有:KCl、KNO3,
故答案为:BaCl2、Na2SO4、NH4NO3;BaCO3;KCl、KNO3.
本题解析:
本题难度:一般
4、简答题 如图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图.

(1)找出在此装置图中出现的错误加以改正______.
(2)实验过程中,在D装置中观察到的实验现象是______;在E装置中观察到的实验现象是______,反应的化学方程式是______;
(3)F装置的作用是______,反应的离子方程式是______.
参考答案:(1)实验室制用浓盐酸和二氧化锰在加热条件下制氯气;除杂时先除去氯化氢,再除去水蒸气,最后收集;氯气的密度大于空气,采用向下排空法收集时应从长管进短管出;
故答案为:稀盐酸改用浓盐酸;B应在A的左边;C中进气管应该长,排气管应该短;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HClO+HCl,盐酸具有酸性,能使紫色石蕊试液变红,次氯酸具有强氧化性,能用于漂白,所以溶液红色褪去,盐酸能与硝酸银反应生成氯化银白色沉淀:HCl+AgNO3=AgCl↓+HNO3,所以在E装置中观察到的实验现象是有白色沉淀生成;
故答案为:溶液先变红后褪色;有白色沉淀生成;Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3;
(3)氯气有毒,为防止污染空气,应用碱液来吸收:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=ClO-+Cl-+H2O.
本题解析:
本题难度:一般
5、实验题 某化学兴趣小组在学习“硫酸及其盐的某些性质和用途”中,进行了如下实验探究:
【实验一】探究浓硫酸的氧化性

(1)写出烧瓶中反应的化学方程式:_______________。
(2)装置B的目的是探究SO2的还原性,请写出B中所用的试剂:___________________(任写一种)。
【实验二】检验(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)中的离子:
(3)请填写实验方案:
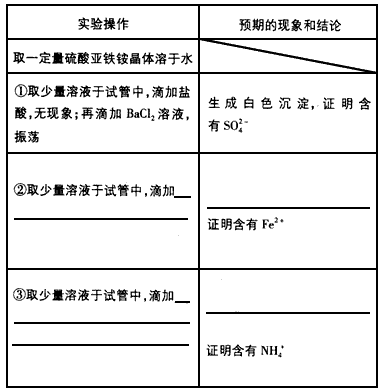
【实验三】用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下

用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:
已知:2MnO4- +5H2O2 +6H+=2Mn2+ +8H2O +5O2↑
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0. 100 0 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
回答下列问题:
(4)电解KHSO4饱和溶液的阳极反应式为___________。
(5)操作②中,滴入第一滴KMnO4溶液,溶液的紫红色消失的很慢,随着滴定过程中Mn2+的增多,溶液的紫红色消失速率加快。Mn2+的作用是_____________________。
(6)原H2O2溶液中溶质的质量分数为_____________。
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)高锰酸钾溶液、氯水、溴水、氯化铁溶液(任写一种)
(3)②KSCN溶液,再滴入几滴新制的氯水;滴加KSCN溶液无现象,再滴加新制的氯水,变为红色;
③浓NaOH溶液,加热,并在试管口用湿润的红色石蕊试纸检验;试纸变蓝(或浓NaOH溶液,加热,用蘸有浓盐酸的玻璃棒靠近试管口有白烟产生)
(4)2SO42- -2e-= S2O82-或2HSO4--2e-=2H++S2O82-
(5)作催化剂(加快反应速率)
(6)3.4%
本题解析:
本题难度:困难