微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ?(附加题1)用1 L 1.0 mol/LNaOH溶液吸收35.2 g CO2气体,溶液中CO32-与HCO3-的物质的量之比为1∶3;反应的化学方程式为_______________________________________。
参考答案:5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O
本题解析:35.2 g CO2气体是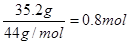 ,氢氧化钠是1.0mol
,氢氧化钠是1.0mol
即二者的物质的量之比是4︰5,而溶液中CO32-与HCO3-的物质的量之比为1∶3
所以方程式为5NaOH + 4CO2=? 3NaHCO3?+? Na2CO3 + H2O。
本题难度:简单
2、选择题 下列说法中错误的是
[? ]
A.化学反应中的能量变化通常表现为热量的变化
B.需要加热才能发生的反应一定是吸热反应
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
参考答案:B
本题解析:
本题难度:简单
3、选择题 共价键都有键能之说,键能是指拆开1mol共价键需要吸收的能量或者形成1mol共价键所放出的能量.如H-H键的键能是436kJ/mol,H-Cl键的键能是431kJ/mol,Cl-Cl键的键能是247kJ/mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJ
B.179kJ
C.89.5kJ
D.以上说法都不对
参考答案:在反应H2+Cl2?点燃?.?2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436kJ+247KJ=683kJ,
生成2molHCl,共形成2molH-Cl键,放出的能量为:2×431KJ=862kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:863kJ-672kJ=179kJ,所以H2和Cl2反应生成1molHCl放出的热量是为89.5kJ,故选:C.
本题解析:
本题难度:一般
4、选择题 已知:C(s,金刚石)=C(s,石墨)△H=-1.9kJ/mol
C(s,金刚石)+O2(g)=CO2(g)? △H1=-a kJ/mol
C(s,石墨)+O2(g)=CO2(g)? △H2=-b kJ/mol
根据已述反应所得出的结论正确的是
A.a>b
B.a=b
C.a<b
D.金刚石比石墨稳定
参考答案:A
本题解析:反应C(s,金刚石)+O2(g)=CO2(g)? △H1="-a" kJ/mol减去
C(s,石墨)+O2(g)=CO2(g)?△H2=-bkJ/mol
得到:C(s,金刚石)=C(s,石墨)△H=b-a=-1.9kJ/mol
即a>b,选A
本题难度:一般
5、填空题 (2014届甘肃省玉门市油田一中高三第三次摸底考试化学试卷)
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g)?△H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式?。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:?。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是?(填序号)
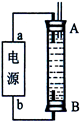
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)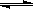 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| CO2
|
1
| 650
| 2
| 4
| 1.6
| 5
|
2
| 900
| 1
| 2
| 0.4
| 3
|
3
| 900
| 1
| 2
| 0.4
| 1
|
?
①实验1中,以v (H2)表示的平均反应速率为?。
②实验3跟实验2相比,改变的条件可能是?(答一种情况即可)
参考答案:(1)CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=—890KJ.mol-1?
CO2(g)+2H2O(l) △H1=—890KJ.mol-1?
(2)CH4-8e-+ 10 OH- CO32-+ 7H2O;?
CO32-+ 7H2O;?
(3) B、D ;
(4)①? 0.16mol/(L·min)?②使用了催化剂;加大了压强(任答一种)
本题解析:
(1)甲烷完全燃烧生成二氧化碳气体和液态水,所以甲烷燃烧热的热化学方程式中甲烷的物质的量是1mol,将①②相加除以2可得,答案是CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=—890KJ.mol-1?
CO2(g)+2H2O(l) △H1=—890KJ.mol-1?
(2)负极发生氧化反应,所以甲烷在负极发生氧化反应,结合电解质溶液,负极的电极反应式为CH4- 8e-+ 10 OH- CO32-+ 7H2O;
CO32-+ 7H2O;
(3)A、电解过程中两极分别是H+和Fe放电生成氢气和亚铁离子,所以两极哪端都可以生成氢气,a不一定为正极,b不一定为负极,但a为正极,b为负极,效果较好,错误;B、在装置中铁一定作阳极,所以氯化钠溶液是电解质溶液,不影响阳极Fe放电生成亚铁离子,阴极H+放电生成氢气,正确;C、装置中铁一定作阳极,阴极可以是铁,也可以是其他惰性电极,错误;D、阴极H+放电生成氢气,正确,答案选BD。
(4)①实验1中,CO2的浓度增加0.8mol/L,所以氢气浓度也增加0.8mol/L,v (H2)= 0.8mol/L/5min=0.16mol/(L·min);
②实验3跟实验2相比,到达平衡时间缩短,说明反应速率加快,反应温度、各物质的物质的量均未变,所以可能是使用了催化剂或增大压强。
本题难度:一般